兼收并蓄对标世界先进
发布时间:2018-12-06 14:37:09作者:戴绪霖来源:医药经济报
“M4:人用药物注册申请通用技术文档模块一”征求意见
M4是ICH组织推荐给各成员国采用的通用注册文件格式,减少人用药注册申请编纂所需的时间和资源,促进审评及与申请人的交流和简化监管机构之间互换监管信息。近期,为进一步落实2018年第10号公告,促进ICH组织指导原则在国内的使用,国家药监局组织起草了《M4:人用药物注册申请通用技术文档模块一(征求意见稿)》。
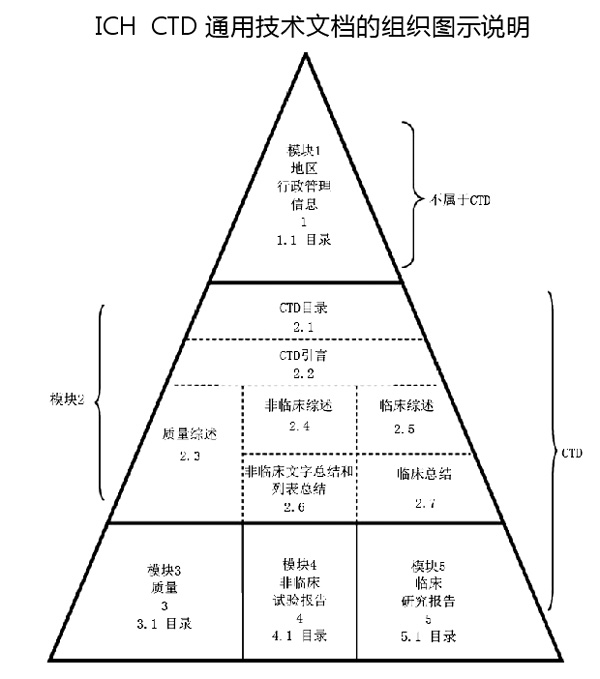
笔者学习后发现,M4模块二至模块五为CTD格式,各成员基本上会根据各国具体情况进行少量微调,内容基本一致。模块一为地区行政管理信息,基本体现了各国药品监管的个性化要求和水平。
本征求意见稿重复了部分模块二和模块三至五等CTD内容。如1.3.1产品特性摘要、1.3.4产品质量标准和生产工艺/制造和检定规程、1.3.5临床试验相关资料、1.3.6.5参比制剂/对照药合法来源文件、1.3.6.7原料药、药用辅料及药包材证明文件。之所以会出现这种情况,与我国CTD文件有时仅有格式而实质内容并不齐全有关。如原料药、药用辅料及药包材证明文件,本来应该放到模块三3.2.S.2.3中详述,模块二2.3.S.2.3中综述,但目前没有放到CTD文件中,而是放在证明性文件中。
此外,美国模块一中有很多信息,本次征求意见稿还没有提到,包括市场专有权请求、除名证明、财务关系证明和有关公开信息、儿科研究管理信息、豁免体内试验的请求、请求对研究知情同意书的豁免、请求免除体内生物利用度试验、对环境影响的分析等,但从这些内容我们可以看到美国FDA等发达国家监管部门的重点关注点何在。
如市场专有权请求,这对已过专利期的药物非常重要。美国FDA通过赋予持有人市场专有权,鼓励企业挑战原研药品的专利权、首仿、开发新的适应症、开发孤儿药、儿科用药等。药品的价值不在于其“物质”,而在于其应用知识。市场专有权等于在不断鼓励持有人,通过临床试验等手段,不断获得新知识,同时降低患者的用药负担。
再比如财务关系证明,目的是杜绝行贿受贿,杜绝为了获取经济利益而以患者安全为代价的现象,杜绝临床试验结果受到与药企财务关系可能的影响。当然,美国FDA模块一中的内容均有其本国法律的支撑,部分内容中国目前还没有这方面的法律规定,并不一定适用(如市场专有权)。由于中国的《药品注册管理办法》中的数据保护制度保护范围有待进一步细化,建议可以在模块一中提出明确的保护范围请求。
值得注意的是,本征求意见稿1.13小微企业证明文件是FDA和EMA模块一中都没有的,体现了国家对小微企业的照顾。当然,欧美在收费上对小微企业也有一些照顾,说明业内都意识到,不仅是大型药企,小微型药企也有其存在的必要性,“大树”和“小草”同时存在,产业生态更好。
中国的药品监管制度要与世界先进水平看齐,需要先进法规规范,M4模块三至五的适用就是例子。
为促进同各国之间沟通交流的便利性,这部分内容自然力求不仅形似还要神似,真正做到“基本一致”。同时中国也有自己的特色,M4模块一就是例子,这是ICH给予我们的权利。当然,即使是地区特色部分的内容,我们也不能闭门造车,要放眼看世界,兼收并蓄,“青出于蓝而胜于蓝”。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



