罕见病定义不同 挑战异曲同工
发布时间:2018-12-04 16:17:19作者:胡善联来源:医药经济报
罕见病定义不同 挑战异曲同工
罕见病在世界各地的定义是不同的。
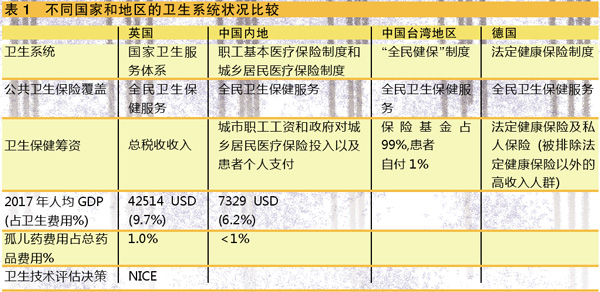
例如,美国将发病患者少于20万的疾病称为罕见病,若以美国3.14亿人口计算,即患病率大约小于6.37/10万人口的疾病。欧盟国家将罕见病定义为患病率小于5/万人口的疾病,如按欧盟各国人口总和5.14亿计算,发病少于25万患者的疾病被列为罕见病;将患者少于1/5万人口的疾病称为超罕见病。日本将罕见病定义为少于5万的患者,如按日本人口1.28亿计算,则是属于患病率小于4/万的疾病。韩国将罕见病定义为少于2万患者的疾病。我国将罕见病定义为小于1/50万人口发生的疾病或小于1/万名新生儿中发生的疾病,据估算,每一种罕见病在中国的患者人数在2800名左右,若按我国大陆总人口13.4亿人口计算,罕见病患者总数应在1680万左右。中国台湾地区将罕见病定义为患病率小于1/万的疾病,为具有遗传性、难于诊断和治疗的疾病。可见,不同国家或地区对罕见病的定义和患病率有不同的界定,这种差异与其人口数量密切有关。
以法布雷氏罕见病为例,该病是一种进行性、遗传性、多系统的溶酶体贮积病,可引起神经系统、心血管系统和肾脏疾病症状,患病率为1~5/万,需要通过酶替代疗法对患者进行治疗。另一个例子是血友病,是一组由于血液中某些凝血因子缺乏而导致患者产生严重凝血障碍的遗传性出血性疾病,患病率为1~9/10万,该病的有效治疗方法是注射重组凝血因子。显然,罕见病的治疗是一种未满足的需要,缺乏质量好的证据,人们也缺乏对疾病的认识和理解,因此,加速对罕见病的研究意义重大。
在第8届亚太地区国际药物经济学与结果研究大会中,有一场关于罕见病的专题演讲,本文对这场报告的精华进行总结并与读者分享。
从上市到获得医保报销路漫漫
一种新的罕见病治疗药物,从面世到获得医疗保险报销需要经历很长的时间。
以治疗疑似特发性肺纤维化(IPF)的新药Pirfenidone(吡非尼酮 pirfenex)为例,在日本从该药上市到获得医疗保险补偿,一般需要2个月的时间。澳大利亚和中国台湾地区对罕见病的新药批准时间一般比非罕见病药物短,大约为4~11个月。而在德国和英国,罕见病新药的批准时间一般要比非罕见病药物的批准时间适当长一些,为13~26个月。在中国和韩国,罕见病的新药批准时间较非罕见病药物批准的时间长得多,一般需要39个月。
未来10年,如果要增加罕见病药物的可及性,需要考虑以下几个因素:
(1)如何保证罕见病治疗的公平可及?
(2)哪些方法可以有效减少罕见病患者,扩大孤儿药的可及性?
(3)如何将这些方法应用到其他卫生系统中?
(4)如何确保能够收集足够的临床和经济学证据使得罕见病患者快速获得治疗?
(5)随着病例数的增加和创新药物的出现,如何制定和调整孤儿药的补偿机制?
亚太地区罕见病防治水平差异大
中国内地:诊治、研究和保障水平等不断提升
会上,笔者介绍了我国在罕见病防治上的最新进展。
2010年5月,中华医学会医学制定了罕见病的定义;2016年,我国发布了可防可治的56个罕见病的目录;2018年6月,五部委联合发布了国家级罕见病目录,第一批共收录121种疾病。然而,迄今为止,全球只有44个罕见病(36.4%)拥有治疗药物,其中只有半数在中国上市。
据笔者了解,2015年北京市所有三级医疗机构均已开展罕见病研究,从40多万电子病例分析中已找到1423种罕见病。其中前六位主要的罕见病为先天性畸形、神经系统、内分泌代谢性疾病、循环系统疾病及骨骼肌肉及结缔组织系统的疾病。另一项协同研究在全国7个省93家三级医院开展,对40.5万病例进行分析,共发现了952个罕见病,占总病例的2.27%。半数以上是先天性疾病,包括血友病、唐氏综合征、川崎病、阵发性夜间血红蛋白尿、血栓栓塞性肺动脉高压(CTEPH)、遗传性小脑无张力调节(SCA)等。此外,还建立了国家罕见病研究协作网络,建立国家级和地区级50种以上的罕见病例登记制度。
2016年原国家卫计委成立了罕见病诊断和治疗专家委员会,优先重点选择部分罕见病,改善患者对孤儿药的可及性。国家医保局通过价格谈判已将部分孤儿药纳入报销范围。药企和红十字会联合开展向患者赠药的援助计划。
与此同时,罕见病的立法环境获得改善:2016年加速了罕见病的立法工作;2017年36个开展价格谈判的新药中有5个是中成药,15个是抗肿瘤药物,14个是慢性病治疗药物,孤儿药则占了2个。2018年我国出版了“中国罕见病的研究报告”,8月国家药监局拟加速审批的48个新药中,其中38%属于罕见病用药。
对于我国未来罕见病的防治,笔者有如下建议:制定罕见病防治规划;在罕见病的防治上要发挥政府和社会保险的作用;加强罕见病的登记和监测系统;建立罕见病的临床中心,发布罕见病临床指南以及整合社会力量措施。
另据笔者了解,我国部分省市已开展了对孤儿药大病保险报销的先行先试工作,如青岛市将一些孤儿药纳入医疗保险报销范围;宁夏开展了针对戈谢氏病孤儿药的报销以及患者援助计划;上海市社会保险将青少年儿童住院保险的封顶线设在每年10万元;浙江省从2016年起,将戈谢氏病、苯丙酮尿症和肌萎缩侧索硬化症纳入社会保险、医疗救助和大病医疗保险报销的覆盖范围。可以看到,中国罕见病的诊治、研究和保障等环境在不断改善,未来将会越来越好。
中国台湾:优化报销、定价方式挑战重重
据台湾大学卫生政策和管理研究所杨铭钦教授介绍,目前台湾地区总人口为2360万,2014-2018年间人口增长率为0.15%。台湾地区在1999年6月制定了“罕见病法案”,2000年1月对罕见病进行了“立法”。
台湾地区罕见病防治的特点是将防治和药物结合在一起。为预防发生、早期诊断和治疗罕见病,对低收入家庭实行医疗费用全额免费,包括提供紧急药物及维持生命所需的特殊营养食品。对需要送去境外检验的项目费用,40%由罕见病基金会补助,40%通过行政部门补助40%,患者自付20%。此外,加大对新生儿的筛检力度,2005年起建立“孤儿药特殊基金”,并按治疗结果进行医保支付试点,对创新药物给予10年治疗的保护期。
台湾地区对罕见病药物的认定有明确的程序,一般管理过程需要45天,最后获批额外需要30天。孤儿药报销方面也存在着很多挑战,如近年来批准的98个孤儿药中只有57个(58%)最终能获得台湾“健保”的报销。不被批准的原因有多种:45%为没有提供成本效果的资料,33%是疗效证据不足,22%是没有被签发新药证书。台湾地区采用的是10个国家的国际参考定价。例如,年销售量上限≤17万欧元时,按10国的中位价上浮20%;如果年销售量在17万欧元以上,又低于34万欧元的罕见病孤儿药,最高限制则按10国中位价上浮10%;如果年销售量大于34万欧元,则取10国的中位价,说明孤儿药的定价高低与销售量有关。
另一种方法是以成本加成定价,对进口的孤儿药计算进口成本包括运输、报销和仓贮费用,外加30%的管理和市场费用。对本地产品则包括制造成本(除外研发费用)以及30%的管理和市场费用。10国的最低价格是制定的一个标准,但孤儿药定价规则比其他药物更宽松一些。
台湾地区从2005年起建立了孤儿药的特殊基金,十多年来孤儿药的费用从开始的11% 增加到25%,总的孤儿药的费用大约在1.79亿美元。2005年起,台湾地区还对血友病治疗药物建立了特殊的基金,免除患者的共付费用。2014年后台湾“健保”可对血友病开展预防性治疗。当前,孤儿药的补偿面临很多挑战,如批准药品补偿的几率较低、评审孤儿药的机制比较复杂、延缓了孤儿药的可及性以及有降低补偿价格的趋势。
德国:市场宽容,卫生费用无爆炸式增长
德国IGES研究所理事会主席Bertram Haussler教授介绍了德国对罕见病的解决方案。
在德国,任何一个新药,包括孤儿药,只要经过欧盟或德国批准,即可上市。只要孤儿药经过临床评价有附加效益,便可获得补偿,不需要特别征求患者的意见。2000年欧盟立法规定,同一类药品治疗指征,新药需要尽早证明其具有附加效益,并通过价格谈判。
当然,孤儿药在德国的发展也曾经历过一个曲折的过程。起始于未被满足的某种罕见病的治疗需要,然后通过罕见病的确定,制定政策和激励措施使治疗人数逐步增加而面临价格制定的挑战,之后又对孤儿药的补偿政策进行再评价,最后才达到可持续性地、公平地、可及性地应用孤儿药的目的。
现今,德国是一个非常吸引和宽容孤儿药的市场,孤儿药在德国新药市场中占30%左右。2001-2015年间,孤儿药获批数量节节高升,2015年被EMA批准进入市场孤儿药有120个之多。德国的孤儿药价格也较高,其也制定了费用阈值,一年超过5000万欧元销售额的孤儿药便需要进行再评估。但从预算影响分析来看,德国并没有因为孤儿药审批而产生卫生费用的爆炸式增长。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



