研发生产外包服务 创新发展加油向未来
发布时间:2018-11-29 12:22:58作者:工信部赛迪智库消费品工业研究所医药研究室主任 曹慧莉来源:医药经济报
为了解我国医药行业创新发展情况,国家工信部、国家发改委等部门近期赴江苏对药明康德、金斯瑞等研发生产外包服务(CRO/CMO)企业调研。调研发现,近年来我国医药CRO/CMO创新发展很快,但仍存在知识产权保护力度不够、关键物料依赖进口、MAH制度和第三方保险制度不完善等问题,如能解决上述问题,对改善我国CRO/CMO创新环境、提升竞争力意义重大。
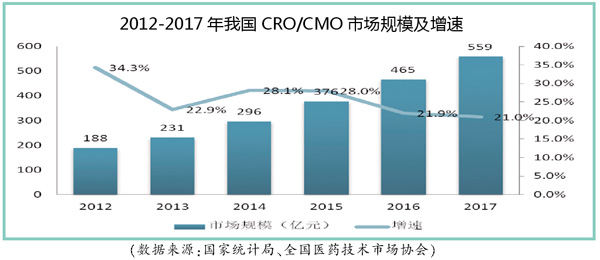
规模扩张
CRO/CMO是我国近二十年来发展起来的新兴行业。近五年,在国家层面大力支持医药行业创新研发、国内企业研发投入的增加、仿制药一致性评价工作的开展和全球医药研发项目逐渐向中国转移等利好因素影响下,我国CRO/CMO呈现高速增长,近5年复合增长率高达24%。特别是以药明康德、泰德制药、金斯瑞为代表的国内骨干CRO/CMO企业,建立了国际领先的全新抗体药开发平台、高表达稳定CHO细胞株构建平台和双特异性治疗抗体平台(SMAB)等创新平台。我国加入ICH后,国际多中心临床试验将成为我国CRO/CMO行业新的增长点。预计到2020年,我国CRO/CMO的市场规模有望接近1000亿元(如图所示)。
三大掣肘
1.知识产权保护力度不够。对于委托方来说,因国内知识产权保护机制不完善,国内大部分制药企业倾向于自行研发新药,以避免因为合作研发或者研发外包导致的知识产权外泄。这导致国内主要创新药项目都集中在制药企业内部,CRO服务需求小、新药研发外包市场规模小。
对于受托方来说,受托的新药项目经常由于宣传需要部分公开试验数据和靶点信息而被剽窃,造成客户关系紧张、知识产权受侵等情况出现。例如,传奇生物的CAR-T免疫细胞疗法就遭遇过侵权。
2.关键物料进口依赖度高。调研发现,国内CRO企业临床前实验阶段所需的关键耗材、物料都依赖进口,国内的耗材物料集中在中低端,不能满足跨国实验项目的要求。日益频繁的贸易摩擦,会增加CRO企业关键物料断供的风险。比如,调研发现企业研发所需要关键物料(如分离T细胞磁珠、T细胞培养液及冻存液等)基本依靠进口。国内知名CRO/CMO企业在MAH制度实行之后,与国内外多家药品研发企业合作,但由于国产器械和耗材没有通过国际认证,不符合多数跨国企业和新型创新生物药项目的生产标准,因此目前主要采用进口器械和耗材。
3.配套体系有待完善。一是国内缺乏一些专业实验室,很多临床前实验只能在国外完成,例如RCL(具有复制能力的慢病毒)实验相关平台。二是MAH制度需要继续深化。虽然MAH制度的出台推动了上市许可和生产许可的分离,但业界期待更多相关实施细则,能够明确指导合同生产过程中委托方与被委托方的具体权责。三是第三方保险机制不完善。药品作为一种特殊商品,药品不良反应事件时有发生。合同研发生产由于涉及多方共同研发生产,不可避免会出现不良反应追责纠纷,而国内目前缺乏保障利益相关方的第三方保险机制。四是创新药激励机制期待更多优惠。一些恶性肿瘤、罕见病领域新药已经进入医保目录,但如果医院控制药占比、采取“零加成”,则医院没有动力采购价格偏高的创新药。
发展建议
首先,要加强创新药的知识产权保护。探索建立药品审评审批与专利链接制度,把药品审评审批和专利关联起来,在药品审批过程中,发现专利侵权纠纷,及时通过法院裁定解决。加快开展药品专利期限补偿制度试点。专利期补偿是指补偿专利权人由于行政审批过程造成的专利保护时间缩短造成的商业损失。此外,还要完善药品试验数据保护制度。行政管理部门对企业申报的数据要采取保护措施,防止被他人商业利用。
其次,推动关键物料国产化。一是加强传统物料提质增效研究,提高和改进传统生物制药物料的生物学性能,支持科研单位深入研究生物材料的表面和界面,发展表面改性技术及表面改性耗材。二是加强医药创新企业与新材料企业的联动,促进国内新材料生产企业开发符合临床前实验需求和高端合同生产需求的物料。三是推动国内企业产品的国际化认证。推动国内企业积极通过美国、欧盟等发达国家和地区的器械、耗材和物料的相关认证。
再次,继续完善配套政策。建议建立特色专业实验平台,选择高校或科研院所针对目前医药创新企业反映强烈的领域建立专业特色实验室,弥补国内实验室资源的不足,为CRO企业提供平台服务,降低企业研发成本。
建议出台MAH制度更多实施细则。药品上市许可持有人制度即将在全国全面推行,出台相关实施细则,明确委托方和受托方的权利和责任,对于规范CMO企业的发展大有裨益。
建议建立合同研发生产第三方保险制度。鼓励大型保险机构根据CRO/CMO特点,开发覆盖药品研发、临床试验、生产、上市销售全环节 “共保”的药品安全责任险,给各个环节提供共同保障。
健全创新药研发使用机制。增加临床研究在医院评级和医生职称评定中的比重,缓解国内临床资源不足。对于进入医保目录疗效明确的创新药采取单独核算,不纳入医疗机构药占比考核,促进创新药的临床使用。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



