美计划基因疗法 试验审批常规化
发布时间:2018-11-28 14:59:05作者:Marilynn Marchione 编译/廖联明来源:医药经济报
美国卫生官员正计划取消针对基因疗法临床试验的特殊规定,有望促进该领域迅速发展。具体来看,此前对基因疗法临床申请进行审评的美国国家卫生研究所(NIH)专家小组将转向承担更广泛的咨询工作,美国FDA将参照其他常规疗法和新药,审评基因疗法的临床试验。
对于迄今为止仅有少数几个新药获批的领域而言,这是一个非凡的里程碑,但并非所有专家都认为基因疗法不需要特别的监管措施。
随着基因编辑技术和其他前沿科技的发展,斯坦福生物伦理学家Mildred Cho认为:“根据我们现有的知识及所能预见的风险,目前还不能对基因疗法的审评做太大的改革。”
FDA独立承担审评任务
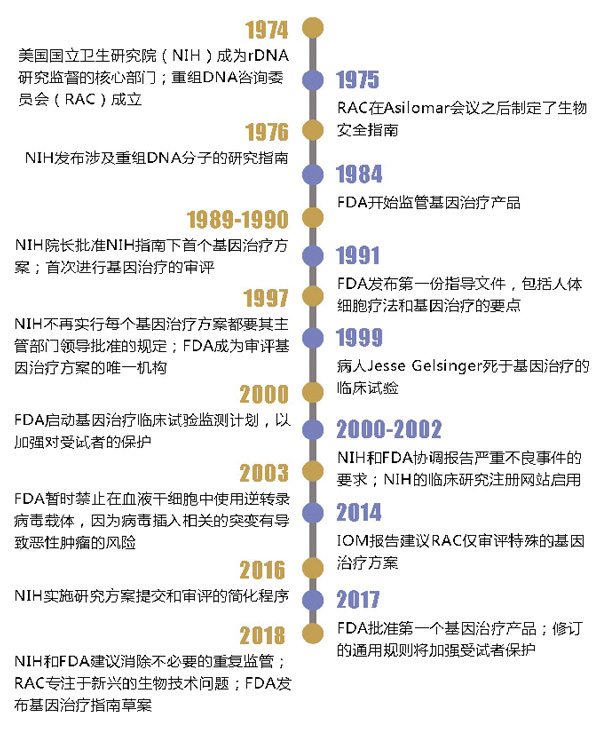
基因疗法可以通过剪切、嵌入或改变DNA,从根本病因上治疗疾病,而不仅仅限于消除由遗传缺陷引起的症状。该技术首次被提出时,存在许多安全问题和科学未知因素,因此NIH建立了一个独立专家小组——重组DNA咨询委员会(RAC),以评估每个基因疗法的研究及对患者的潜在风险。1999年,一名青少年患者在基因治疗的临床试验中死亡,使该领域骤然遇冷。
自那以后,人们对基因治疗的安全性有了更多认识。去年,FDA批准了美国首批3种基因疗法,分别用于治疗癌症和遗传性失明症。
近日,FDA局长Scott Gottlieb与NIH所长Francis Collins在《新英格兰医学杂志》(NEJM)发表文章表示,现在是时候让FDA自行审评基因治疗方案,而不需要RAC的重复工作。相关建议目前正在向公众征求意见。
目前,有700多项基因疗法正在开展研究,“基因疗法将成为治疗许多疾病的主要方法,之前我们用来审评其他科学领域的相关工具现在非常适合基因疗法。”上述文章写道。
几位行业内专家同意这一观点。美国明尼苏达大学生物伦理学中心的Leigh Turner表示,FDA可以适当调整审评策略,他不认为这是一种明显的放松管制,“我们不想对基因疗法临床试验的监管漠不关心或过于保守,要仔细审查每一个项目,无论是由一个机构还是2个机构审查,都和以往一样重视。” 约翰斯·霍普金斯大学生物伦理学院院长Jeffrey Kahn表示,此举与几年前医学研究所的建议是一致的。“我们有保护患者的制度和措施,基因疗法研究不再需要被视为临床研究的特殊类型。”
高风险需重视
不过,身为RAC成员的Cho指出,基因疗法是极复杂的生物学疗法,并且在很多情况下,我们并不明白其作用原理,“基因疗法给病人带来的奇迹般的恢复和缓解是我们前所未见的,但也有令人非常痛心的失败结果。”
尤其需要注意的是,根据现行规定,基因治疗只能用于通过改变DNA治疗出生后有遗传病的病人,禁止用于改变胚胎、卵子或精子中的遗传物质,因为这些改变是永久性的,且具有遗传性。
“如果FDA考虑调整基因疗法的审评策略,应该是加强而不是放宽审评机制。” 遗传与社会中心(Center for Genetics and Society)执行主任Marcy Darnovsky表示,该组织主张加强监督和负责任地使用生物技术。
编译/廖联明
来源/AP新闻
美国基因疗法监管历史
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



