欧盟孤儿药十八年战况
发布时间:2018-11-28 11:13:24作者:李轩(中国医药工业研究总院)来源:医药经济报
目前,医学界已知的罕见疾病有6000多种。欧盟将发病率低于万分之五的疾病界定为罕见病。在欧盟,大约有3000万人患有罕见病,这意味着每17个人中就有一个人患有罕见病(基于欧洲5.1亿人口的估计)。
找到有效治疗罕见病的方法是个巨大的挑战。治疗罕见病的药物很少,原因之一在于企业不太可能从这么少的患者身上收回药物研发成本,因而需要政府提供激励措施。
从2000年起,欧盟就启动了孤儿药认定(orphan medicinal product designation)计划。欧盟对罕见病治疗药物开发的政策支持力度很大,对企业而言颇具吸引力,也收获并上市了不少孤儿药。
激励政策
在欧盟,为了获得相关激励,只要符合特定的标准,企业就可为其药物申请孤儿药认定。
其孤儿药认定的标准为:1)药物必须是用于治疗、预防、诊断危及生命或使人长期衰弱的疾病,或者不太可能以药物的预计收益来证明其研发投入的适宜性;2)在欧盟的发病率低于万分之五;3)没有满意的诊断、预防或治疗方法,或者有相关的方法但研发的药物能给条件受限的患者带来重大益处。
EMA(欧盟药物管理局)的孤儿药委员会(COMP)负责审查孤儿药认定的申请。如果已认定的孤儿药进入上市许可审批阶段,COMP将再次对其进行评估,以检查其是否仍符合标准,以及孤儿药的状态能否持续到上市许可批准。
在孤儿药的研发过程中,企业可从EMA给予研究方案的科学建议、各种费用减免以及欧盟资助等激励措施中获益。批准上市许可的孤儿药,以及能够证明其持续符合孤儿药认定标准的药物,将获得10年市场保护期。EMA的这些特定激励,使得孤儿药的研发对企业更有吸引力。事实上,随着罕见病在各国日益受到重视,孤儿药已然成为各大药企的研发重点。Evaluate Pharma预计,2022年全球处方药销售额将超过1万亿美元,其中32%的销售额增长将来自孤儿药。
认定近2000个孤儿药资格
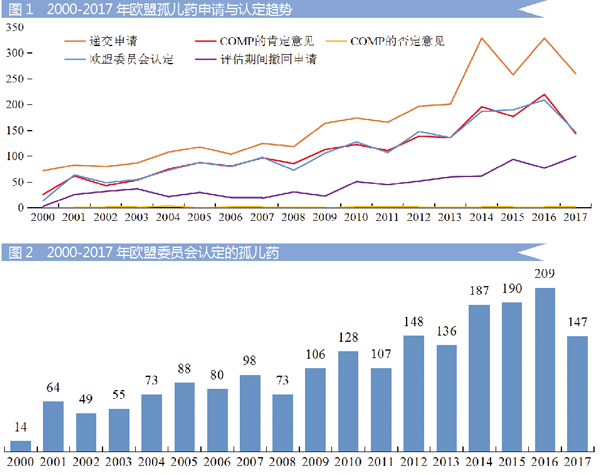
2000-2017年,EMA共计收到2974个孤儿药认定申请;COMP对1971个申请给予肯定意见,对25个申请给予否定意见;欧盟委员会认定1952个孤儿药资格;评估期间申请人撤回784个申请。具体情况见图1与图2。
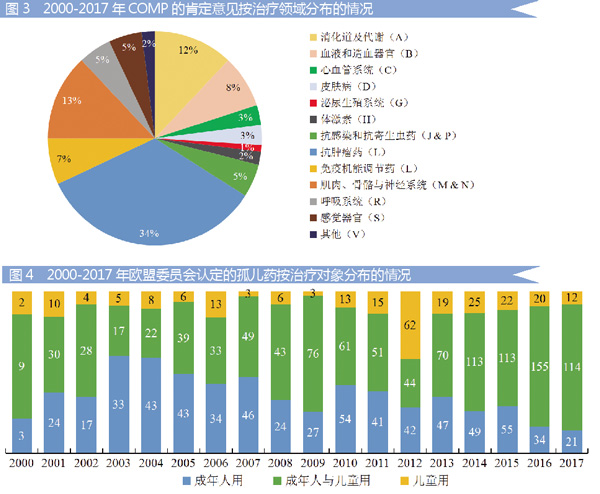
进一步分析2000-2017年COMP的1971个孤儿药肯定意见,在治疗领域的分布情况为:抗肿瘤药约占34%;其次为肌肉、骨骼与神经系统用药,约占13%;消化道及代谢用药约占12%。具体情况见图3。
2000-2017年EMA认定的1952个孤儿药的治疗对象分布情况为:儿童用药248个,约占12.7%;成年人用药637个,约占32.6%;成年人与儿童共用药1067个,约占54.7%。具体情况见图4。
142个孤儿药获上市批准
孤儿药认定不是上市许可,况且并非所有被认定的孤儿药都能到达上市许可申请(marketing authorisation application,MAA)的阶段。
EMA的人用药品委员会(Committee for Medicinal Products for Human Use,CHMP)按照与其他药物同样严格的标准,对孤儿药的安全性和有效性进行评估,并给EMA的最后决策提供建议。一旦孤儿药的上市许可申请得到EMA的批准,它就可以在所有欧盟成员国上市。但是,孤儿药的可获得性和可补偿性还需有关国家当局进行审查,各国情况会有所不同。
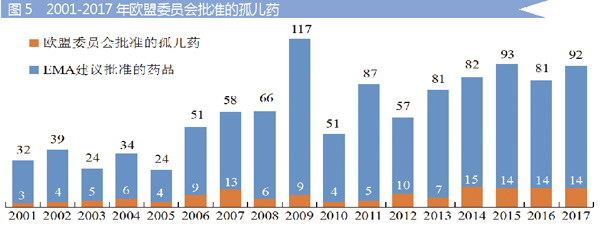
2001-2017年,已有142个孤儿药在欧盟上市,给患者提供新的治疗选择。具体情况见图5。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



