三类肿瘤药,利好各不同
发布时间:2018-11-22 14:50:10作者:本报特约撰稿 镜陆来源:医药经济报
12个境外已上市临床急需肿瘤新药分析
为加快境外已上市临床急需新药进入我国,国家药品监督管理局、国家卫生与健康委员会组织有关专家对近年来美国、欧盟或日本批准上市新药进行了梳理,遴选出了Alectinib Hydrochloride等48个境外已上市临床急需新药名单。
该名单重点考虑近年来美国、欧盟或日本批准上市我国尚未上市的用于罕见病治疗的新药,以及用于防治严重危及生命或严重影响生活质量的疾病,且尚无有效治疗手段或具有明显临床优势的新药。
根据相关规定,纳入境外已上市临床急需新药名单的药品,尚未进行申报的或正在我国开展临床试验的,经申请人研究认为不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,国家药品监督管理局将按照优先审评审批程序,加快审评审批。这意味着48个产品若进入《境外已上市临床急需新药名单》正式稿有可能在国内获得加快审评。
肿瘤作为最热的治疗领域,在该名单中也占比最大,肿瘤药共12个产品进入名单,占25%。咸达药海遨游数据对这12个产品的国内申报情况与未来趋势进行分析点评。
【A】国内已上市类
1 Alectinib Hydrochloride(阿来替尼)

阿来替尼由罗氏/Excella联合开发,入选“境外已上市临床急需新药名单”的适应症为“间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌、非小细胞肺癌”。入选理由是“第三代ALK激酶抑制剂,对现有治疗克唑替尼耐药患者仍有效,与克唑替尼比较的研究显示本品可显著延长无进展生存时间(25.7vs10.4),有突出优势”。
其已纳入优先审评名单,理由是与现有治疗手段相比具有明显治疗优势。2018年8月,该品种150mg上市,商品名为安圣莎,注册证号为H20180047。
2015年、2016年,该药在国内启动阿来替尼的临床试验CTR20150592、CTR20160367,与克唑替尼比较治疗ALK阳性晚期非小细胞肺癌的疗效。
点评:实际上,盐酸阿来替尼胶囊无需进入此名单就已获批上市。非小细胞肺癌是肿瘤中最热的适应症,预计原研药上市后,仿制药也会跟进。
2 Pembrolizumab(帕博利珠单抗)

帕博利珠单抗为默沙东研制产品,入选“境外已上市临床急需新药名单”的适应症为“晚期黑色素瘤、转移性黑色素瘤、非小细胞肺癌、头颈癌、黑色素瘤”。入选理由是“美国首个批准的PD-1抑制剂,在多个肿瘤中均显示了疗效,尤其在非小细胞肺癌一、二线治疗均证实了长期生存获益”。
其已纳入优先审评名单,理由也是与现有治疗手段相比具有明显治疗优势。2018年7月,该品种100mg/4ml获批上市,商品名为可瑞达(美国商品名为KEYTRUDA),注册证号为S20180019。
2016年起,默沙东已在国内开展对晚期或转移性黑色素瘤、晚期胃腺癌、晚期食管癌、晚期肝细胞癌、转移性鳞状非小细胞肺癌治疗的临床试验。
点评:2018年7月帕博利珠单抗注射液在国内是以黑色素瘤适应症获批上市的,进入“境外已上市临床急需新药名单”后,非小细胞肺癌适应症有望加快获批。
18 Palbociclib(哌柏西利)
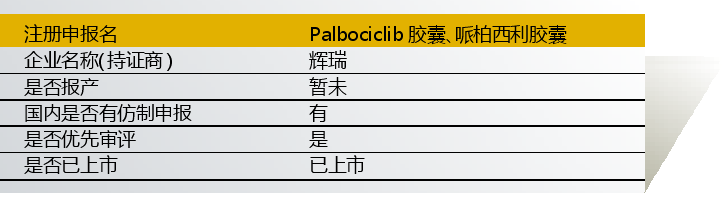
哌柏西利由辉瑞研制,入选“境外已上市临床急需新药名单”的适应症为“乳腺癌”。入选理由是“全球首个上市的CDK4、6抑制剂,在全球临床试验中显示出了突出的临床获益”。
2014年起,该药在国内开展ER(+)、HER2(-)女性绝经后晚期乳腺癌临床试验。
该药以与现有治疗手段相比具有明显治疗优势为由获得优先审评。目前已上市3个规格,125mg(H20180040)、75mg(H20180041)、100mg(H20180042)。
国内药企仿制申报活跃,包括康美、南京海纳、正大天晴、浙江海正、江苏恒瑞、江苏万邦、瑞阳制药/北京阳光诺和、山东罗欣、江苏奥赛康和齐鲁制药等。
点评:本产品仅申报临床就已获批上市。作为指南一线用药,市场潜力大,仿制药竞争也会非常激烈。
【B】上市提速类
3 Olaparib(奥拉帕尼)
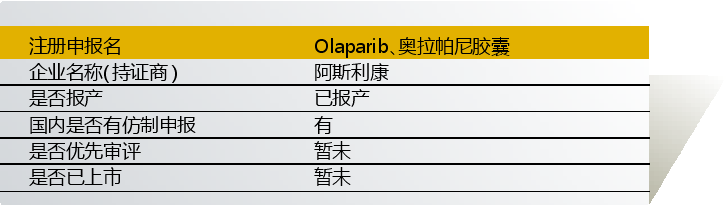
奥拉帕尼由阿斯利康和艾伯维联合开发,入选“境外已上市临床急需新药名单”的适应症为“晚期卵巢癌、原发性腹膜癌、输卵管癌、上皮性卵巢癌、BRCA突变的晚期卵巢癌”。入选理由是“卵巢癌为常见妇科肿瘤,晚期疾病以化疗为主。Olaparib为全球首个开发的PARP抑制剂,Ⅲ期研究显示,相对安慰剂组,Olaparib可明显延长无进展生存(19.1vs5.5)。基于突出的临床优势,国外批准用于复发的铂敏感复发性卵巢上皮癌的维持治疗,目前中国尚无药物批准用于该人群,存在明确临床需求”。
2014年起,该药已在国内开展对晚期胃癌、BRCA突变的晚期卵巢癌、gBRCA1/2突变且高危HER2阴性完成辅助(新辅助)治疗的早期原发性乳腺癌、实体瘤的临床试验。
目前奥拉帕尼尚未在国内上市。但国内药企仿制药申报活跃,包括正大天晴、瑞阳制药/北京阳光诺和、南京华威、北京康立生、四川科伦、江苏豪森、山东罗欣等。
点评:原研药有望加快获批上市。暂无仿制药开始BE研究,但已有不少仿制药完成药学研究。原研药上市后,预计仿制药也会积极加快启动BE研究。
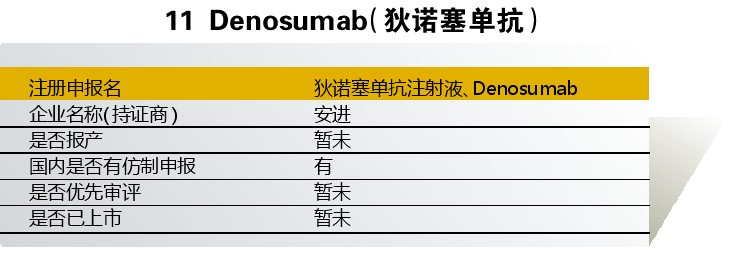
狄诺塞单抗由安进与葛兰素史克联合开发,入选“境外已上市临床急需新药名单”的适应症为“骨转移性实体瘤、骨癌、实体瘤、巨骨细胞瘤、多发性骨髓瘤、高钙血症、类风湿性关节炎、骨质疏松症”。入选理由是“骨巨细胞瘤发病率低,3/100万,好发于青壮年,对手术切除可能导致严重功能障碍的患者以及不可切除的中轴骨病变患者确无有效的治疗手段,Denosumab国外研究显示达到70%以上的肿瘤缓解率”。
2013年起,该药已在国内启动骨质疏松、预防实体瘤骨转移患者发生骨相关事件的临床试验。
目前狄诺塞单抗尚未在国内上市。但国内仿制方面,菲洋生物科技(吉林)/苏州康宁杰瑞生物已开展临床研究。
点评:原研药有望加快上市申报,且暂未开展临床试验的适应症都有望获批。
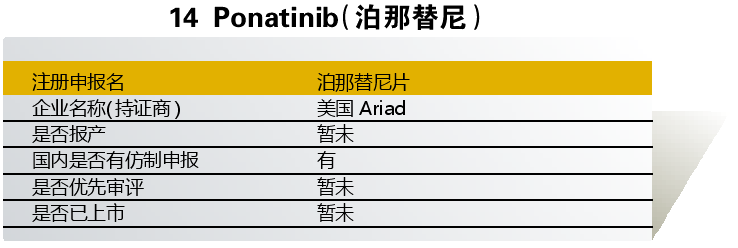 泊那替尼由日本大冢制药与美国Ariad联合开发,入选“境外已上市临床急需新药名单”的适应症为“慢性髓细胞性白血病、急性淋巴细胞白血病、白血病”。入选理由是“Ponatinib 为第三代Bcr-Abl激酶靶向抑制剂,对T315I突变型Bcr-Abl激酶具有高效特异性抑制作用,可有效解决现有以伊马替尼为代表的靶向抑制Bcr-Abl激酶的CML治疗药物普遍存在的、因激酶突变引起耐药性的缺陷”。
泊那替尼由日本大冢制药与美国Ariad联合开发,入选“境外已上市临床急需新药名单”的适应症为“慢性髓细胞性白血病、急性淋巴细胞白血病、白血病”。入选理由是“Ponatinib 为第三代Bcr-Abl激酶靶向抑制剂,对T315I突变型Bcr-Abl激酶具有高效特异性抑制作用,可有效解决现有以伊马替尼为代表的靶向抑制Bcr-Abl激酶的CML治疗药物普遍存在的、因激酶突变引起耐药性的缺陷”。
该药目前尚未在国内上市,也未在国内开展临床试验。国内仿制方面,仅杭州德润玉成生物申报了原料药(普维替尼)。
点评:虽在国内尚未启动临床试验,但原研药有望直接申报上市并加快获批。2016年该药在日本获批,带有红色警告标签。

Enasidenib mesylate由新基研制,入选“境外已上市临床急需新药名单”的适应症为“急性骨髓性白血病”。入选理由是“Enasidenib 是全球首个批准的针对IDH2突变的成人AML患者的药物,IDH2突变在AML中大约占17%。对于复发难治的AML目前尚无标准的有效治疗,国外研究显示本品在具有IDH2突变的复发难治的AML中获得23%的完全缓解率和8.2个月的缓解持续时间”。
目前该药暂未国内上市。2017年,该药在国内启动针对急性髓系白血病(CTR20170961)的临床试验。
点评:原研药有望加快上市申报。
【C】罕见病类
入选“境外已上市临床急需新药名单”的肿瘤药中,有5个品种属于罕见病类别,包括Vismodegib、Dinutuximab、Sonidegib、Olaratumab、Dinutuximab Beta。这5个品种都是未启动国内申报、未启动国内临床、未上市的品种。
此外,除了基因泰克研制的Vismodegib目前有国内仿制申报(包括南京华威、北京依诺泰/长沙手性、正大天晴)之外,其余4个产品都未有国内仿制申报。

点评:该品种原研药暂未开展国内申报。对于罕见病,仿制药是否也可以拥有加快审评的优待,仍待政策的进一步落实。

点评:罕见病市场非常小。以上4种新药国内暂无原研药和仿制药申报,如果入选目录,尚不了解会否有企业采取进口代理方式引进国内。
结语<<<
8月20日《国务院办公厅关于印发深化医药卫生体制改革2018年下半年重点工作任务的通知》发布,国家医保局、国家卫生健康委、国家药监局负责有序加快境外已上市新药在境内上市审批。这意味着类似的目录未来会越来越多,临床必需的境外产品上市也会越来越多。
对入选“境外已上市临床急需新药名单”的肿瘤药进行分析可以发现,有些产品此前因优先审评已获批上市,个别产品将受益于未获批的适应症。部分产品国内临床未完成或未开展,也有望通过此政策在国内实现快速上升。
但是,部分罕见病产品,原研药未有打算进入中国,国内想要上市该产品,只能通过仿制药或者代理原研产品。而无论是哪种方式,在市场不够大的情况下,都需要在政策支持下,企业才有动力引进或仿制。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



