儿童用药安全 还可以做什么
发布时间:2018-11-21 14:21:35作者:沈阳药科大学工商管理学院 王淑玲 李丽来源:医药经济报
6月12日,国家药监局发布公告,要求在8月15日前,相关生产企业对丹参注射剂修订说明书,并在说明书【禁忌】项中,明确禁用人群,其中明确标注新生儿、婴幼儿、孕妇禁用。6月27日,国家药监局药品审评中心发布通知,拟决定将含阿片类成分可待因的药物禁用于18岁以下儿童和青少年。
丹参注射液说明书修改和含阿片类成分可待因的药物禁用于儿童等,使得儿童用药安全话题的热度持续升温,政府对儿童用药安全越来越重视。
重视儿童用药安全
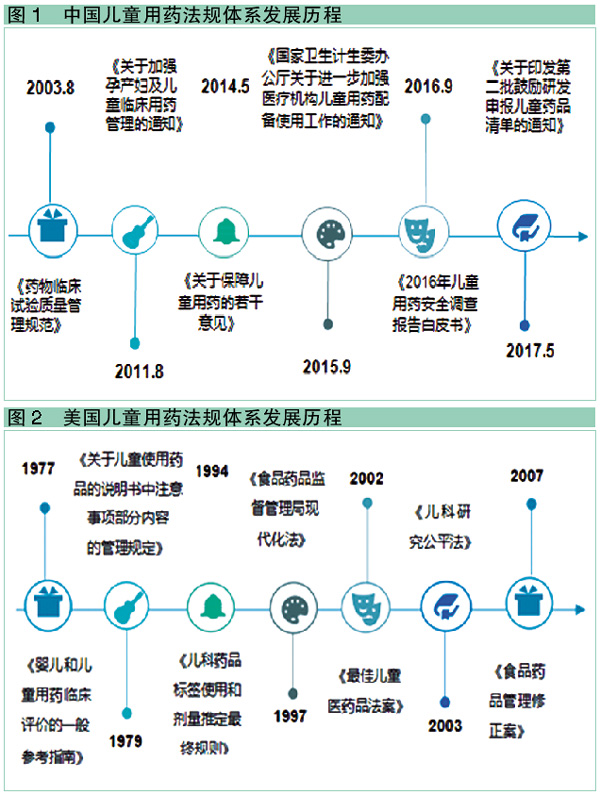
2003年8月,国家食品药品监督管理局发布《药物临床试验质量管理规范》,正式将儿童纳入药物临床试验对象,但规定儿童作为受试者时必须取得其法定监护人的知情同意并签署知情同意书,当受试儿童能作出是否参加研究的决定时,还必须征得本人同意。因此,在儿童中开展临床研究有一定难度。
2011年8月,为进一步加强孕产妇及儿童临床用药管理,保障孕产妇及儿童临床用药安全,卫生部办公厅发布了《关于加强孕产妇及儿童临床用药管理的通知》,要求医疗机构针对孕产妇及儿童建立药物遴选制度,加强处方权及调剂资质管理,规范药物临床应用管理,加强处方和医嘱点评工作。
2014年5月,原国家卫计委、CFDA等六部门联合印发了《关于保障儿童用药的若干意见》。这是我国关于儿童用药的第一个综合性指导文件,对儿童用药价格给予政策扶持,儿童专用剂型可单列代表品,不受成人药品定价水平影响;发挥医保对儿童用药的保障功能,按规定及时将儿童适宜剂型、规格纳入基本医疗保险支付范围。
2015年9月,《国家卫生计生委办公厅关于进一步加强医疗机构儿童用药配备使用工作的通知》出台,对医疗机构儿童药品的使用做了进一步的规范。
2016年9月,国家食品药品监督管理总局南方医药经济研究所发布了《2016年儿童用药安全调查报告白皮书》指出,我国儿童药物不良反应率为12.5%,是成人的2倍,新生儿是成人的4倍,儿童不合理用药、用药错误造成的药物性损害更严重。
2017年5月,原国家卫计委、工信部及原食药监总局围绕我国儿童疾病谱以及相关企业研发生产能力,联合发布了《关于印发第二批鼓励研发申报儿童药品清单的通知》,鼓励企业研发并申报儿童适宜品种的药品,以满足儿科用药需求。
长期以来,我国儿童药品的重要地位不突出,药品大法《中华人民共和国药品管理法》和《药品注册管理办法》均未对儿童药品提出特殊规定。一方面我国缺乏针对儿童药品的法律,关于儿童药品的规定大多分散在多部药品法规中,未充分体现儿童保护的重要性。另一方面缺乏有效的监管和激励政策,在现有关于儿童药品的法规条例中,没有制定有效的激励措施和强制性条款促进和规范儿童药品研发和生产。近两年,国家加强对儿童用药安全的重视,但离目标还有一定差距。
美国立法历经30年
步最早,为加强儿童用药管理,美国食品药品监督管理局发布了一系列法律法规。
1977年,FDA以建议性指南的方式发布了《婴儿和儿童用药临床评价的一般参考指南》。
1979年,FDA发布《关于儿童使用药品的说明书中注意事项部分内容的管理规定》,建议企业根据成人的研究资料,在药品的说明书中增加“儿童用药”的相关内容。
1994年,FDA发布《儿科药品标签使用和剂量推定最终规则》,这是对上一个规定的进一步修订,允许将成年人用药的安全性和有效性数据作为儿童用药依据:如果该适应症治疗成人与儿童的病症相似,便可以参考成人的数据;如果疾病情况不同,就必须进行独立的儿童临床试验进行评价。
1997年,美国国会通过《食品药品监督管理局现代化法》,从立法的角度鼓励药品生产商进行儿童药品临床试验研究,规定凡进行过儿科药品临床试验的新药拥有6个月的专利权延长期,提高了药品生产商开展儿童药品临床试验的积极性。
2002年,FDA发布《最佳儿童医药品法案》,强制要求药品生产商进行由美国国立卫生研究院赞助的儿科药品临床试验。
2003年通过的《儿科研究公平法》授权FDA批准由药品生产商赞助的儿科药品临床试验作为激励机制和公共基金机制的补充手段。
2007年,FDA进一步对上两部法案进行修订,通过了《食品药品管理修正案》,要求政府机构及时发布药品和生物制品进行儿童临床试验的信息。
美国自1977年发布针对生产厂商的指南到上升至立法层面历经近30年,建立了一套系统的法律体系保障儿童用药安全,显著提高了儿童用药的可及性和安全性。
软硬兼施促发展
美国在20年前就确立了“儿科独占”的激励儿童药品研发的法律制度,延长了儿科药品专利独占保护期,《最佳儿童医药品法案》则为药品生产商提供了经济上的支持。这些法规体现了美国政府对药品生产商的鼓励,提高了药品生产商对儿童临床试验的积极性。
我国的药品研发模式以仿制药为主,导致我国儿童药品临床试验研究不足,缺少儿童临床试验数据。儿童药品研发成本高、临床试验难度较大等原因,大大降低了药企研发儿童药品的积极性。我国发布的《药物临床试验质量管理规范》中对儿童参与药物临床试验的规定过于死板,并且大部分中国家长对儿童临床试验认识不足,反对儿童临床试验,两者在很大程度上限制了我国儿童临床试验的发展。
为此,我国应对药品生产商开展儿童临床试验实行鼓励政策,设立鼓励机制,加大对药企在资金、技术方面的支持,提高源头药企的积极性,同时对药企行为进行合理规范;建立专业的儿童药品临床试验基地,提高儿童药品研发生产的专业性和创新性。
当然,仅有鼓励政策并不能有效规范儿童用药,为此美国发布的《儿科研究公平法》显示了立法者的威严,强制性规定要对药品和生物制品的新有效成分、适应症、剂型、给药剂量或途径等提出新药申请或补充申请,该法案授予了FDA强有力的监管权,使得药品审批过程更加公平与透明。
美国这种软硬兼施的手段都是为了一个共同的目标,即提供新的儿童药物信息和药品标签,鼓励药企进行儿童药品临床试验,在儿童用药方面取得了良好成效。我国应加强对儿童用药的监管力度,合理规范药品生产商行为,建议政府赋予国家药品监督管理局对儿童用药研究监管的权利,专门开设儿童用药审评中心,对部分新药上市强制性要求开展儿童临床试验研究,建立评估必须的具体指标,确保儿童药品的安全性,同时给予药企儿科药品专利独占保护期,保护他们的权益。
目前,我国儿童药品监管方面的信息透明度、公布率偏低,不利于药品研究人员、医生、患者及时了解儿童药品发展动向,建议政府在法律允许的范围内多公布有关儿童药品各方面的信息,提高儿童药品信息透明度。我国在儿童安全用药方面起步较晚,需借鉴发达国家成长的经验,取其精华,去其糟粕,根据国情选择适合的方法。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



