重磅新靶点“错位”攻略
发布时间:2018-11-19 19:27:49作者:马乐伟(本报特约科睿唯安)来源:医药经济报
重磅新靶点“错位”攻略
PARP抑制剂全球竞争白热化,“白马”“黑马”“后来者”该如何占位?
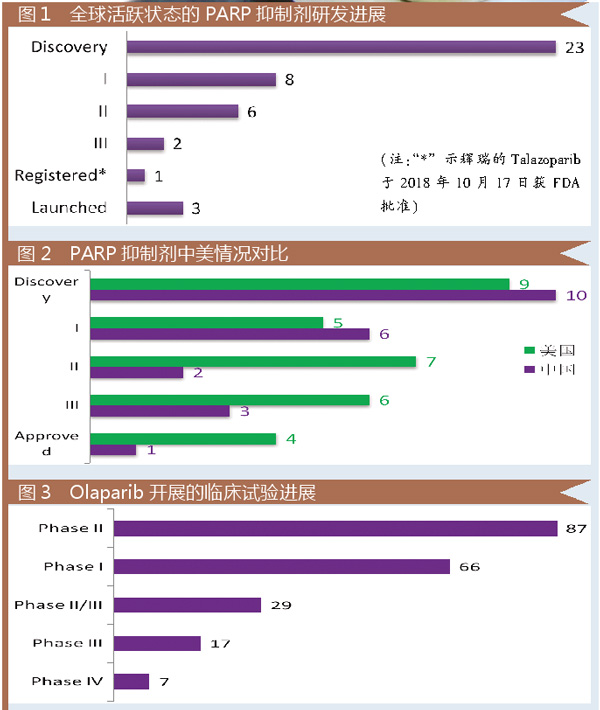
目前,全球PARP抑制剂的竞争格局激烈。全球处于活跃状态的PARP抑制剂共43个。其中已上市3个、完成注册1个、Ⅲ期2个、Ⅱ期6个、Ⅰ期8个、临床前23个。
从地域分布来看,中国、美国、韩国、英国、澳大利亚位居前五。其中,中国以18个的数量位居全球第一。
从中美两国的PARP抑制剂所处的阶段情况看,美国处于开发后端的产品数量较多(获批数量,美国4 Vs. 中国1),而中国处于开发前端的占比较大(Ⅰ期及之前数量,中国16 Vs. 美国14)。
10月22日,阿斯利康与默沙东在ESMO2018年会上联合公布了Olaparib最新的Ⅲ期临床结果,这一积极结果将使Olaparib在卵巢癌的维持治疗中获一线用药地位。一时间,PARP抑制剂再度成为行业热点。那么,应该如何在日趋白热化的PARP抑制剂领域中占位呢?
Olaparib“白马攻略”
★委曲求全也要第一个上市
★从“四线”拼到“一线”
★大手笔拓展适应症,同时开展206个试验
阿斯利康(以下简称AZ)的Olaparib可谓该领域名副其实的First-in-class“白马”。
2014年12月19日,Olaparib以Ⅱ期临床数据获FDA批准,用于卵巢癌的治疗。随后,临床试验不断在乳腺癌、胰腺癌、胃癌等领域开展。截至目前,Olaparib在卵巢癌和乳腺癌两个领域中均获批。
整体来看,Olaparib的发展及获批路径如下:
Olaparib在卵巢癌领域的发展路径,从侧面体现了AZ的上市策略:先以四线上市,再逐步向二线和一线拓展。
而这“委曲求全”的策略背后,与Olaparib早期的临床数据息息相关。
AZ早期开发的目标适应症是三阴乳腺癌,在相关Ⅱ期临床几乎无应答后,才将其重心限定在gBRCA突变的乳腺癌及其新辅助治疗上。
新的研发重心并非一帆风顺。2014年2月,AZ提交了该药用于铂类治疗复发的gBRCA突变卵巢癌维持治疗的上市申请。2014年6月,FDA对该药疗效的可靠性提出质疑。最终,FDA肿瘤药物咨询委员会(ODAC)以11:2的投票结果反对Olaparib的加速批准。
随后,AZ拿出了一个比较关键的Ⅱ期临床数据(NCT01078662):对已接受三种或更多化疗方案治疗的gBRCA突变的卵巢癌患者,Olaparib客观缓解率(ORR)为34%;中位缓解持续时间是7.9个月。即参与临床试验34%的患者平均有7.9个月的ORR。数据并不是很漂亮,但基于该数据,Olaparib成为全球第一个上市的PARP抑制剂。
幸运的是,SOLO1、SOLO2和Study19三个临床试验结果比较给力。
SOLO2和Study19两个试验证明,无论患者是否gBRCA突变,Olaparib均可用于对铂基化疗有反应的卵巢癌的维持治疗。这一适应症的拓展极其重要,它使Olaparib从卵巢癌“四线”一跃进入“二线”。
SOLO1试验即2018年10月22日刚刚公开的重磅数据:Olaparib作为维持疗法,能够将gBRCA突变的晚期卵巢癌患者的疾病进展或死亡风险降低了70%。
基于该数据,AZ与Merck已经启动该适应症的补充申请。至此,Olaparib在卵巢癌领域从“二线”挺进了“一线”。
在乳腺癌领域,OlympiAD临床试验证明,与化疗组相比,Olaparib显著延长了患者的PFS(中位7.0 vs 4.2个月),将疾病进展或死亡风险降低了42%。基于该数据,Olaparib成为FDA批准的第一个用于gBRCA突变型乳腺癌的PARP抑制剂。
除了卵巢癌和乳腺癌外,AZ针对其他适应症的拓展也在积极进行中。据科睿唯安Clinical Trials Intelligence统计,针对Olaparib,AZ在全球同时开展了206个临床试验。
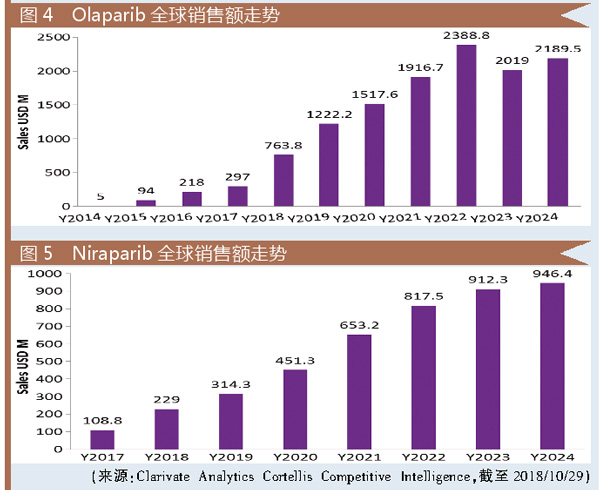
笔者不禁感叹,也只有这种Big Pharma能同步开展如此多临床试验。有投资者预测Olaparib在2022年全球销售额将突破23.88亿美元。
Niraparib“黑马攻略”
★幸运!首个卵巢癌二线治疗药
★交易接力!全球范围转让区域性权益
★错位拓展适应症
2016年夏天,Niraparib成为当时最引人瞩目的“黑马”:Tesaro公布Ⅲ期临床数据当天,股票暴涨108%,市值从17.06亿美元飙升至35.48亿美元。
2017年3月,Niraparib获FDA批准,用于对铂基化疗有完全或部分反应的成人复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌的维持治疗。在卵巢癌二线治疗领域进展最快的Niraparib,如愿以偿实现了“全球第一个用于卵巢癌二线治疗的PARP抑制剂”的梦想。
从获批时间看,Niraparib比Olaparib在卵巢癌二线治疗上提前获批了6个月。并且从对比数据看,Niraparib对gBRCA突变的卵巢癌更有优势。
得益于以上优势,Niraparib在上市后短短3个月内成为美国医药市场上处方量最大的PARP抑制剂。分析师预测,该药2024年将突破9.4亿美元。
相较于Olaparib,Niraparib一开始就以二线用药获批,比Olaparib幸运得多。但在卵巢癌一线治疗的研发进度上,又比Olaparib进度慢了不少。
Niraparib在全球权益的交易也颇有看点。Niraparib最早属于Merck,从2008年9月开始,Merck先后在卵巢癌、血液肿瘤、恶性淋巴瘤、胶质瘤及黑色素瘤等领域折腾近4年。在对其失望之后,于2012年5月将该药独家授权给Tesaro。
Tesaro拿到Niraparib后,分别在卵巢癌、乳腺癌、尤因肉瘤等领域开展进一步研究。自2016年获得积极的Ⅲ期临床数据之后,Tesaro开始在全球范围内转让Niraparib的区域性权益。
在中国,再鼎于2017年7月向CFDA提交了Niraparib(ZL-2306)的IND申请,目前已将ZL-2306在小细胞肺癌、二线卵巢癌、一线卵巢癌三个适应症的临床推向了Ⅲ期。
适应症拓展方面,除卵巢癌外,Tesaro还开展了Niraparib在乳腺癌、肺癌的Ⅲ期临床。这些领域能否“逆袭”,只能交给时间了。
后来者攻略
首个卵巢癌三线的Rucaparib
【错位看点】暂无
Clovis公司的Rucaparib是“全球第一个用于卵巢癌三线治疗的PARP抑制剂”。
该药最初属于辉瑞。与默沙东类似,在经受几次临床失败后对PARP抑制剂失去耐心,并于2011年6月将Rucaparib独家授权给Clovis。经过Clovis五年半的努力,Rucaparib终于在2016年12月获FDA批准,用于gBRCA突变的卵巢癌的三线治疗。2018年4月,又获FDA批准用于卵巢癌的二线治疗:用于对铂基化疗有完全或部分反应的成人复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌的维持治疗。
Rucaparib与Olaparib的上市策略如出一辙:都先在四线或三线获批,再向市场更广阔的二线推进。不过,Rucaparib二线获批时间比Niraparib和Olaparib都晚,而其临床也不占优势。
除固体制剂外,Clovis还开发了该药的静脉注射剂,主要目标适应症为三阴乳腺癌的新辅助治疗。从2015年公布的Ⅱ期临床结果来看,该药与顺铂联用后对乳腺癌的疗效及安全性与顺铂单用相比几乎没有改善。
最强效的Talazoparib
【错位适应症】mCRPC
Talazoparib据说是最强效的PARP抑制剂(体外活性为同类化合物的2~10倍)。2015年8月,Medivation从BioMarin手里以4.1亿美元预付款加上1.6亿美元里程碑的代价买断了Talazoparib。2016年8月,辉瑞收购Medivation后将Talazoparib纳入麾下。2017年12个公布的关键性临床试验(EMBRACA)数据显示:与化疗组相比,Talazoparib显著延长了患者的PFS(中位8.6 vs 5.6个月),将疾病进展或死亡风险降低了46%。基于该数据,2018年10月,FDA批准该药用于gBRCA突变的HER2-阴性转移性乳腺癌的治疗,Talazoparib也成了FDA批准的第二个用于gBRCA突变型乳腺癌的PARP抑制剂。
与Olaparib相比,从获批时间看,Talazoparib晚了9个月。但在对gBRCA突变、HER2-阴性乳腺癌(VS安慰剂组)的PFS临床数据上,Talazoparib略占优势:Talazoparib为8.6月:5.6月,而Olaparib为7.0月:4.2月。
除乳腺癌之外,辉瑞还启动了Talazoparib用于转移性前列腺癌(mCRPC)一线及二线用药的Ⅲ期临床。
Veliparib能否峰回路转?
【错位适应症】NSCLC
不在卵巢癌和乳腺癌上“死磕”,艾伯维的Veliparib走了与众不同的道路——主攻乳腺癌和NSCLC。
遗憾的是,2017年4月份公布的数据显示:Veliparib在三阴乳腺癌以及NSCLC的两个Ⅲ期临床试验中均未达到主要临床终点。
因此,Veliparib这个在NSCLC上走得最快的PARP抑制剂,能否成为全球第一个用于NSCLC的PARP抑制剂,只能寄希望于后期的Ⅲ期临床数据了。
中国速度
截至目前,国内上市的PARP抑制剂只有Olaparib。该药于2014年9月获批临床;2017年12月,进口上市申请获CDE受理;2018年1月纳入优先审评(与现有治疗手段相比具有明显治疗优势);2018年8月获批,用于铂敏感的复发性卵巢癌的维持治疗。与此同时,该药治疗乳腺癌在中国的试验也已进入了Ⅲ期临床。
除Olaparib之外,再鼎的Niraparib和百济神州的Pamiparib进展最快,目前均处于Ⅲ期。
在笔者看来,两家公司各有优势:再鼎擅长从海外拿权益,并在国内快速上市,目前已将Niraparib在小细胞肺癌、卵巢癌两个领域的临床推向Ⅲ期;百济神州为专注于肿瘤药的创新型公司,研发实力一流,Pamiparib在卵巢癌、胃癌和乳腺癌三个领域均已进入Ⅲ期。
再鼎将Niraparib引入了中国,国际中小型创新公司进入中国的速度明显加快;百济神州将Pamiparib从当年的Ⅰ期推到了Ⅲ期,代表了本土创新型公司的“中国速度”。未来到底谁能坐上国内PARP抑制剂的“第二把交椅”,我们拭目以待。
目前国内拥有临床阶段PARP抑制剂的公司还有:江苏豪森(Ⅱ期)、青峰药业、人福医药、上海创诺、英派药业(均处于Ⅰ期)。
总结<<<
新靶点的开发能够吸引大量资本、人才及新型公司的参与,但往往也会导致白热化的竞争格局。因此,准确分析竞争对手,并制定行之有效的开发策略,成为这类药物开发的重中之重。
目前PARP抑制剂已上市4个产品(Olaparib、Rucaparib、Niraparib和Talazoparib)。分析各产品的开发历程和策略可以发现,通过“相同适应症的错位性定位”“不同适应症的差异化布局”,才能找到自己的位置。在国内普遍“盲目跟风”的医药大环境下,这一点弥足珍贵。
未来,创新型肿瘤药在发达国家和中国上市的时间差会越来越小,国产创新肿瘤药的可及性也会越来越高。而特别需要一提的是,一个新药的成功上市,离不开数以万计的专业人员在基础研究、专利布局、CMC开发、PC研究、临床设计、工艺放大、注册申报、生产质量控制等方面的紧密配合。而这种高效运转的体系的搭建,并非一朝一夕之功,对此我们准备好了吗?
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



