修美乐200亿市场涌入抢食者
发布时间:2018-11-19 18:51:33作者:Sarah Neville来源:医药经济报
修美乐200亿市场涌入抢食者
生物类似药的大机会来了。近日,全球最畅销药物修美乐(Humira)一项长达15年的专利在欧洲到期,这个接近200亿美元的市场争夺战已经打响。
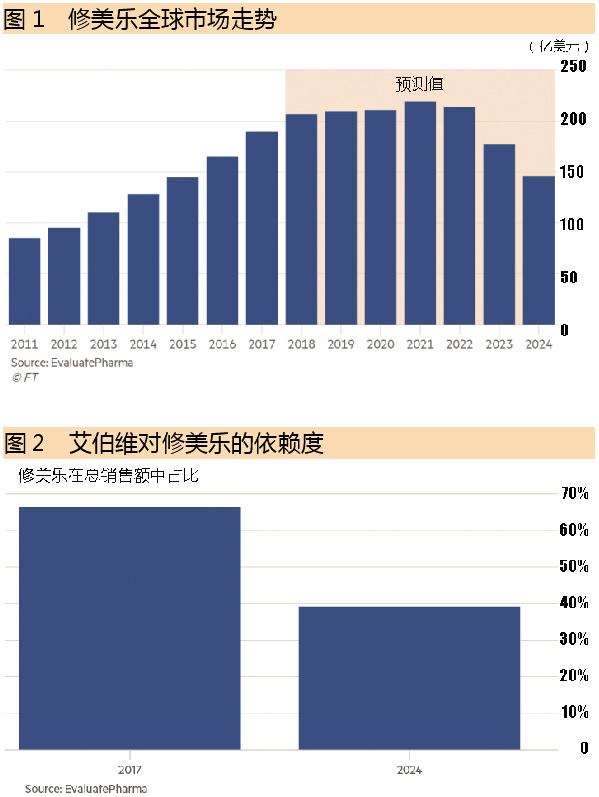
根据EvaluatePharma的数据,去年修美乐为艾伯维(AbbVie)带来了184.30亿美元的销售额,但据预测,到2024将降至141.9亿美元。
在准备争食的生物类似药企业中,日本富士的京华麒麟生物制品公司(Fujifilm Kyowa Kirin Biologics)已将欧洲的市场权益独家授予了迈兰(Mylan);安进(Amgen)、山德士(Sandoz)、百健(Biogen)、三星生物技术(Samsung Bioepis)的生物类似药也都已在欧洲获批。
此外,勃林格殷格翰(BoehringerIngelheim)仍然在与艾伯维进行专利诉讼,尽管其生物类似药已在欧盟获批,但还没有上市的计划。
NHS力促原研替代
迈兰首席商业官托尼·毛罗(Tony Mauro)表示,该公司在欧洲已经制定了稳固的上市计划。他指出,这是一个40亿美元的市场,修美乐的适应症包括类风湿性关节炎、牛皮癣和克罗恩病等,仅英国每年就在该药上花费6.35亿美元。“市场肯定会兴奋起来,因为这个产品在许多政府和卫生系统的支出排行中即使不是第一也是名列前茅。”
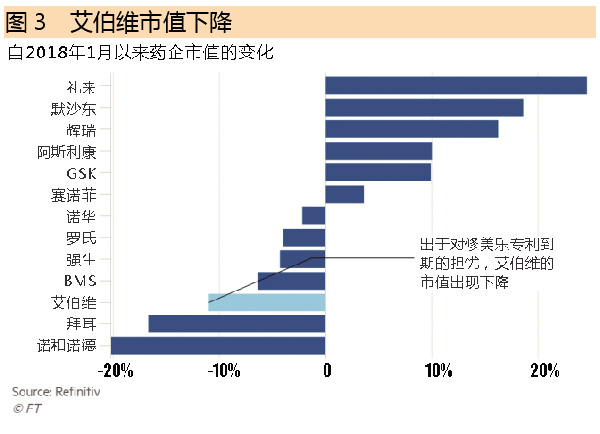
对于艾伯维来说,迫在眉睫的专利期满是一个重大威胁。2017年,修美乐在该公司的销售额中占66.4%,根据Evaluate预计,这一占比在6年内将下降到39.2%。艾伯维一直努力通过美国法院保护其专利,目的就是将修美乐的生物类似药在其最大市场的上市时间推迟到2023年。
在一份声明中,艾伯维表示“欢迎已证明与原研产品一样安全有效的生物类似药进入市场。”不过,其也同时指出“那些在现有生物药治疗上保持稳定状况的病人,不应该因为非医学原因而转用另一种产品。”艾伯维也在修美乐的基础上开发了一系列的后续产品,这些产品使该公司在免疫治疗领域保持领先地位,推动其销售收入持续增长。
信用评级机构穆迪公司(Moody’s)在其关于生物类似药市场的报告中指出,来自生物类似药的竞争,或复杂生物药的后续版本,显示出原研药企面对的威胁日益严重。
推动这种转变的是全球卫生系统共有的迫切需要,即降低不断增长和老龄化人口的医疗负担。欧洲在采用生物类似药方面领先于全球,如英国国家医疗服务体系(NHS),对于罗氏(Roche)的利妥昔单抗(Rituximab),已有80%符合条件的患者改用生物类似药。
英国《金融时报》曾报道NHS一份关于修美乐生物类似药市场的试行指导文件,该文件指出:“我们的目标是在生物类似药上市3个月内,至少90%的新病人会使用生物类似药,已经使用原研药的病人中至少有80%在12个月内转为使用生物类似药。”
为了实现这一目标,NHS想出了一个新办法:其近日发布的第二份文件指出,虽然价格最具竞争力的供应商将赢得更大的市场份额,但所有供应商都会在收到规避垄断的投标后至少占有一些市场。
诺华(Novartis)旗下的仿制药企山德士近日宣布,已在全球范围内解决其生物类似药Hyrimoz与艾伯维所有的知识产权诉讼问题,该药上市在即。
山德士总经理Tim de Gavre表示,NHS现在把重点放在了修美乐,其认为,在促进生物类似药的使用和节约药品支出方面,美修乐的生物类似药会有很好的表现。
药企紧抓“专利悬崖”机遇
不过,对于生物类似药制造商来说,一个长久以来的担忧是,它们面临的折扣要求可能是自己无法承受的。与小分子仿制药不同,生物类似药从开发到上市可能需要长达9年的时间,耗资高达2亿美元;而小分子仿制药一般最多仅需3年时间,开发成本只有几百万美元。
迈兰总裁拉吉夫·马利克(Rajiv Malik)建议,医保部门在做决策时应该考虑产品的质量和供应的持续性,而不仅仅是价格,“不能为了降低成本把价格降到企业无利可图的水平。”
安进研发的修美乐生物类似药Amjevita将在所有28个欧盟成员国家以及挪威、冰岛和列支敦士登公国上市,该公司生物类似药部门管理层Chad Pettit表示,生物类似药节省费用的力度少于传统仿制药,其定价取决于市场动态及所在地区和国家。他同时指出,高质量、可靠供应的生物类似药将具有提高药品可及性,为病人、医保部门、医院、卫生系统节省成本的潜力。
虽然欧洲对修美乐生物类似药的上市感到兴奋,但给美国患者开出这些药物还需要一段时间。
安进率先与艾伯维达成协议,在2023年之前不会在美国推出修美乐的生物类似药,迈兰、三星Bioepis和山德士也纷纷效仿。
勃林格殷格翰是唯一一家拥有FDA批准的生物类似药,但尚未在美国与艾伯维达成协议的公司,其表示打算在法律的允许下,尽早在美国推出修美乐的生物类似药,肯定在2023年前。
此外,虽然勃林格殷格翰计划将其生物类似药Cyltezo带给欧洲患者,但由于其与艾伯维在美国的专利诉讼,该药目前不会在欧盟上市。
当前,美国对生物类似药的接受程度总体上是很差的。在一份最新报告中,信用评级机构穆迪指出:“生物类似药在美国的采用迄今为止是缓慢的,主要原因在于许多重磅生物药受到的专利保护以及生物类似药医保报销的挑战。”
辉瑞正在对强生提起诉讼,称后者违反了美国反垄断法,妨碍了其针对英利昔单抗(Remicade)的生物类似药的推广。专家认为,该诉讼案的判决结果可能会决定美国生物类似药发展未来的走向。
穆迪指出,辉瑞、诺华、百健、安进和迈兰已经有上市的生物类似药产品,未来两年其还会上市更多产品。“无论是原研药企还是仿制药企,都把生物类似药作为未来收入的增长点,在生物药的第二波专利悬崖即将来临之际,更多的公司希望借此机会进入这个市场,并希望未来生物类似药的开发成本可以进一步降低。”
编译/廖联明 来源/FT
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



