罕见病药物中国机会
发布时间:2018-11-19 17:35:54作者:科睿唯安来源:医药经济报
罕见病药物中国机会
第一批121个罕见病名单的公布,开启了在中国发展罕见病用药的第一扇门,被视为中国政府重视罕见病及罕见病药物市场需求的第一步。
由此,罕见病药物如何在中国获得上市,成为罕见病领域发展的重要议题。在美国,罕见病药物2017年上市成功率甚至达到100%。那么,罕见病药物上市后成为重磅药的机会有多少?在中国的机会又有多大呢?
[全球销售额]
罕见病重磅药:不罕见!
根据Cortellis竞争情报数据,全球罕见病药物年销售额估计将从2018年的1,380亿美元成长至2024年的2,620亿美元(年复合成长率为11.38%)。
部分罕见病药物有望进入年销售额达10亿美元级别重磅药物名单,例如用于治疗克罗恩病(Crohn’s disease)的Remicade,治疗多发性硬化症(multiple sclerosis)的Copaxone,以及用于治疗B细胞非霍奇金淋巴瘤(non-Hodgkin’s B-cell lymphoma)的Rituxan。其中有部分药物从首次上市距今已超过20年仍能高居重磅药物之位。如表4所示,三种重磅药物中的Remicade和Rituxan也已在中国上市。
另外,根据Drugs to Watch 2018的统计,罗氏最近刚被FDA批准上市、用于治疗A型血友病的Hemlibra,在2019年就有望达到重磅药级别,预计年销售额14.57亿美元。另外,用于治疗遗传性家族性转甲状腺素类淀粉蛋白变性(hereditary transthyretin-mediated amyloidosis,hATTR amyloidosis)的Patisiran,是首个(first-in-class)RNA干扰(RNAi)药物,刚于2018年8月由FDA批准上市,估计在2021年可达重磅级别,年销售额11.04亿美元。
罕见病药物龙头:很值钱!
最引发关注的是2018年初日本武田制药开价623亿美元巨额收购罕见病药物龙头Shire。
Shire目前共有33个罕见病已上市药物,并且其产品线上还有超过100个在研药物。透过Cortellis的虚拟并购(virtual merger)分析,在武田并购Shire后,可强化临床后期的产品线,且合并后的公司将侪身全球TOP10大药厂之列。
[中国特色]
仅四成药物可在中国购得
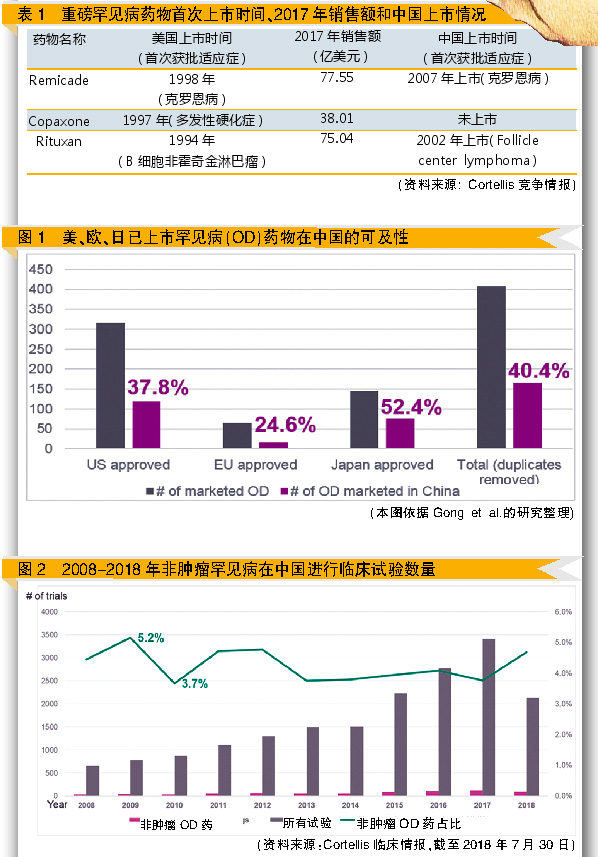
Gong et al.在2012年对罕见病用药的中国可行性相关的调查报告指出,在美国、日本、欧洲已核准的408个罕见病药物中,仅有40.4%(408个罕见病药物中的165个)可以在该调查中的24家三甲医院购得药物(见图1)。其中18.9%是原研药,45.8%是通用名药;165个在中国可获得的罕见病药物中,有120个药物可由医保支付;平均治疗费用为4843.5美元,相当于中等收入城市居民505.6天收入。根据Gong的调查,大部分可获得的罕见病药物仍超过一般收入者的负荷。
中国罕见病种类扫描
发生在中国的主要罕见病包括:苯酮尿症(phenylketonuria)、地中海贫血(thalassemia)、重型海洋性贫血(thalassemia)、成骨不全症(osteogenesis imperfecta)、高血氨症(hyperammonemia)、有机酸血症(organic academia)、威尔森氏症(Wilson's disease)、重症肌无力(Myasthenia gravis)、结节性硬化症(tuberous sclerosis complex)、白化病(albinism)等。
其他的罕见病如血友病(hemophilia)、庞贝氏症(Pompe disease)和因醣脂质无法分解而堆积在体内造成的法布瑞氏症(Fabry disease)。其中,在中国被诊断出的法布瑞氏症患者比例还不到5%。
儿童罕见病则包括雄激素不敏感症(androgen insensitivity syndrome)、肋膜肺母细胞瘤(pleuropulmonary blastoma)、横纹肌肉瘤(rhabdomyosarcoma,含腺泡型和胚胎型两种子型)、Blau症候群(Blau syndrome)、Bardet-Biedl氏症候群(Bardet-Biedl Syndrome)和先天性眼球震颤(Infantile nystagmus syndrome)等。
定义和界定不清是大问题
罕见病约影响中国1600万人,估计发病率是每30万~50万人约有1名病患。目前,在中国公布的罕见病数据尚不完整,也没有足够的财务支援罕见病治疗,仅有部分患者能得到治疗。也尚未公布关于罕见病在中国的特别法及相应条款,使得罕见病患者接受治疗的可及性受到影响。
多数情况下,主要药政市场界定罕见病用两个标准:一是绝对数量,比如低于25万人口;二是百分比,比如低于万分之一等。
然而,中国有13亿人口基数,这两个标准无论用哪个,都将是一个值得关注的数字,对支付部门(医保或者保险公司)都是巨大的负担。第一批罕见病目录的121个罕见病虽已颁布,但对中国罕见病的界定依然不清晰。笔者认为,这个建设性的目录,或许是征求临床医师需求意见之后,考量中国自身的首要需求,率先推进一批罕见病的研发和治疗。
多为后期试验
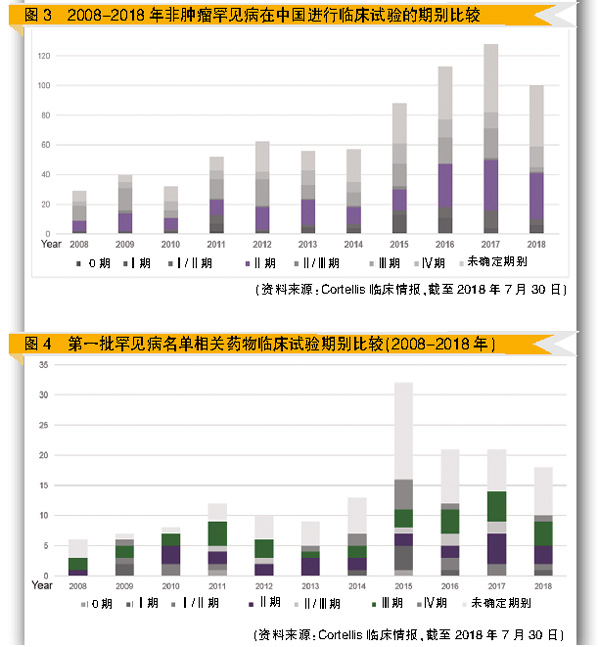
为揭示非肿瘤罕见病用药在中国的临床试验趋势,笔者观察了第一批罕见病目录中的121个非肿瘤罕见病,进一步分析近十年在中国的临床试验及非肿瘤罕见病用药的临床试验趋势。(参考图2和图3)
平均而言,在中国进行的临床试验中,4.3%为非肿瘤罕见病的临床试验。其中又以Ⅱ期临床(通常被视为枢纽试验,pivotal trials)的数量最多,紧接着是Ⅳ期临床(上市后的药品监控试验)以及Ⅲ期临床试验。在中国执行的多为后期临床试验,笔者估计与上市策略或与监管法规要求有关。
整体而言,2015年后公开的临床试验数量有明显成长,如图4所示,第一批罕见病名单的121个适应症在中国的临床试验,也是后期临床试验数量最多。
进一步分析第一批罕见病名单中的临床试验可以发现,比例最高的是神经疾病相关的罕见病,占40%;其次是血液相关的罕见病(占29%),包括第八凝血因子缺乏、第九凝血因子缺乏和血友病,也是后期临床试验居多数。
中国自2015年开始进行药政改革,新的罕见病药物可适用包括优先审评、接受境外临床试验数据以及临床试验改采备案制等措施,反映药监部门对创新及加速新药上市的重视。预期未来中国正式公布罕见病定义后,中国罕见病发展远景将会更清晰。
结论<<<
罕见病药中国空间在这里
根据Gong et al.的研究,在美国、欧洲和日本核准上市的罕见病药物中,分别仅有37.8%、24.6%和52.4%能在中国三甲医院购买到。相较于上述国家,中国尚未公布依据人口或患病率而定的罕见病官方定义,也没公布针对罕见病上市的特别法或优惠。
可以预期的是,若由国家计划保证覆盖明确的罕见病,将推动中国罕见病患者的医疗保障。
未来,罕见病药物申请人的请求,有可能获得豁免临床试验或减少受试者人数的机会。
已在其他国家上市的罕见病药物,有可能以特别法规范其上市及销售,如有望获得有条件批准上市,并被要求在上市后补充试验数据。
其他关键措施可能还包括:比照其他药政市场允许罕见病以快速通道的上市路径、免除大规模临床试验、对罕见病药物的特别许可,以及配合建立病患网络和治疗费用报销等。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



