FDA发布生物类似药行动计划
发布时间:2018-11-01 20:54:21作者:综合编译/廖联明来源:医药经济报
FDA发布生物类似药行动计划
近日,美国FDA发布了备受期待的生物类似药行动计划(BAP),旨在推动降低生物药的价格。FDA局长斯科特·戈特利布(Scott Gottlieb)指出,仅有不到2%的美国人使用生物制剂,但这类药品支出却占所有处方药支出的40%,并且贡献了2010-2015年间药物支出增长的70%。
破除两大阻力
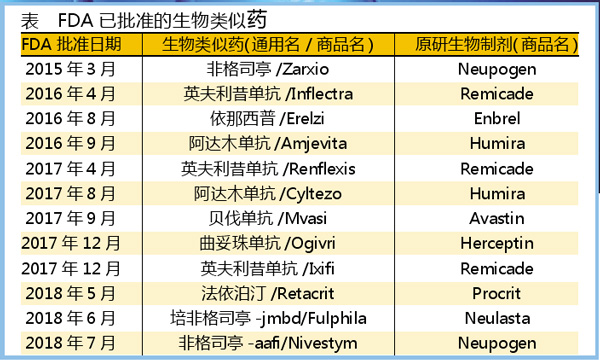
截至目前,FDA已经批准了12种生物类似药,但只有3个在美国成功上市。在发布BAP的演讲上,戈特利布公开批评了那些阻止生物类似药上市的原研药企。
戈特利布指出,一些制药商正在使用反竞争策略,如利用诉讼手段和返利计划,阻止生物类似药进入市场。“对于那些试图用不公平的手段恶意延迟或破坏生物类似药竞争对手进入市场的公司,我们不想采用类似打地鼠游戏的监管模式,我们不打算等上十年或更长时间才引入生物类似药的市场竞争。”戈特利布表示。
根据FDA即将发布的最新分析,如果FDA批准的生物类似药均成功上市,美国2017年医疗支出可以节省超过45亿美元。
“这些品牌制药商不是靠单纯的商业运营取得成功的,他们是聪明的竞争者。但这并不意味着我们需要接受或同意他们的做法是对的,对于药品供应链的每个成员来说,他们的一些策略是不可接受的。”戈特利布直言。
诉讼手段是保护知识产权的一种方式,但常常也被用于阻止生物类似药和化学仿制药竞争对手进入市场。例如,安进(Amgen)通过专利诉讼来防止其类风湿性关节炎重磅药品Enbrel的生物类似药进入美国市场。而早在2016年8月,FDA就批准了诺华(Novartis)旗下山德士(Sandoz)的一只Enbrel生物类似药。此外,Samsung Bioepis的一只Enbrel生物类似药已在欧洲上市销售。
艾伯维(AbbVie)为其重磅药品修美乐(Humira)建立起严密的专利保护网络,阻挡了生物类似药的挑战。安进、Samsung Bioepis与迈兰(Mylan)均与其达成协议,推迟自己的生物类似药在美国上市的时间。
戈特利布指出,除了诉讼,FDA还发现原研药企在生物类似药进入市场之前,就通过大幅度的返利计划和长年合同来锁定药品支付方,从而占领市场、阻碍竞争。
助推临床应用
虽然专利诉讼与药品支付方合同都不属于FDA的管辖范围,但通过BAP,该机构有自己的11条计划来帮助激活停滞的生物类似药市场。
戈特利布强调了四项措施,包括提高生物类似药和可互换药品的审评效率及相关政策的透明度,以及加强与患者、医生和支付方的沟通,以提高对生物类似药的了解等。FDA还建立了一个新部门——治疗性生物制品和生物类似药办公室,该部门将根据《生物类似药使用者付费法案》促进相关工作的协调。
瑞士信贷分析师指出,BAP并没有提供可互换的生物类似药研发的更多细节。目前,化学仿制药被广泛地认定为“可互换”,或被视为等同于原研药,而FDA批准的生物类似药仅被认为是“高度相似”,这意味着它们预计会产生相同的临床疗效。可互换性的认定可以使患者和医生更容易、更快地接受生物类似药产品。
戈特利布强调,FDA还需要与其它机构合作来协调药品报销和药品医保目录制定的相关事宜,以鼓励适当应用生物类似药。Gottlieb透露,FDA正与联邦贸易委员会合作采取措施以抑制一些制药企业的反竞争行为。
瑞士信贷分析师认为,这可能会导致对强生(Johnson & Johnson)Remicade的以价换量保护市场的策略,以及艾伯维推迟修美乐生物类似药上市的协议进行更严格的审查。
FDA还在研究生物类似药申请在美上市时只需证明其与欧洲市场上的原研药是一样的即可,无需证明其与在美国销售的原研药是一样的(绕开在美国买不到原研药作为参比制剂进行临床研究的障碍)。
戈特利布此前透露,某些在欧美市场销售的生物制剂可能就是由同一工厂生产的。“我们正在考虑是否可以与欧洲药品监管部门签订数据共享协议,让生物类似药生产商可以利用欧洲的产品作为参比制剂。”戈特利布表示。
美国药物研究和制造商协会(PhRMA)表示,支持政府为促进市场竞争所做的努力,并指出生物类似药可能在很大程度上节约社会医疗成本。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



