国家带量采购政策下一站
发布时间:2018-11-01 11:40:09作者:周若婧 杨松 江滨(北京大学药学院)来源:医药经济报
“4+7”试点方案特点、存在问题与完善方向剖析
国家带量采购政策下一站
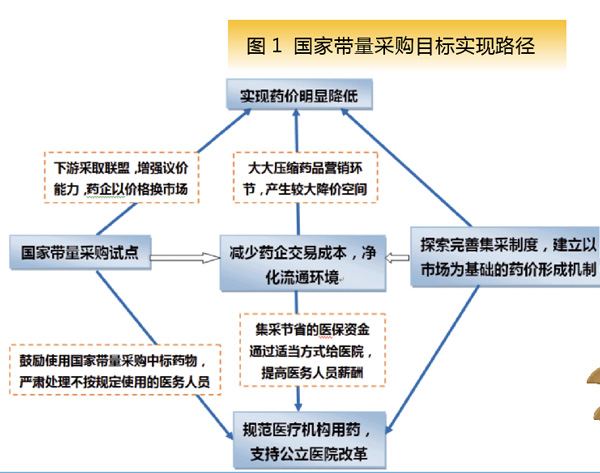
2018年9月28日,“4+7”联合采购办公室在北京召开了带量集采(试点)第三次座谈会。至此,国家试点带量采购的方式基本确定。由国家组织,利用上海平台进行操作,通过聚集“4+7”试点地区60%~70%市场份额作为标的,“以量换价”换取原研品种或通过一致性评价品种最低报价,实现“降低药价”的目标。通过医保手段提供经济激励约束机制,配合绩效考核与惩处措施,构建起确保中标品种顺利使用的机制。
壹
试点方案四大特点
1.以降价为目标
国家“带量采购”通过“以量换价”的方式降低药品价格。本次试点区域选取“4+7”(北京、上海、天津、重庆和沈阳、大连、广州、深圳、厦门、成都、西安)共11个城市,涉及这些城市60%~70%的市场份额。
相较于上海“带量采购”,本次试点更大范围聚集了采购量。由于选取的试点城市药品采购量在全国占比相对较多,11个城市药品市场大概能达到全国的20%~30%,因而国家“带量采购”中标企业将直接获得全国12%~21%的市场。由于标的物采购量更大,预计降价效果优于上海“带量采购”。另外,最低价独家中标的采购规则亦体现出“降价”的目标导向。
2.品种选择基于一致性评价
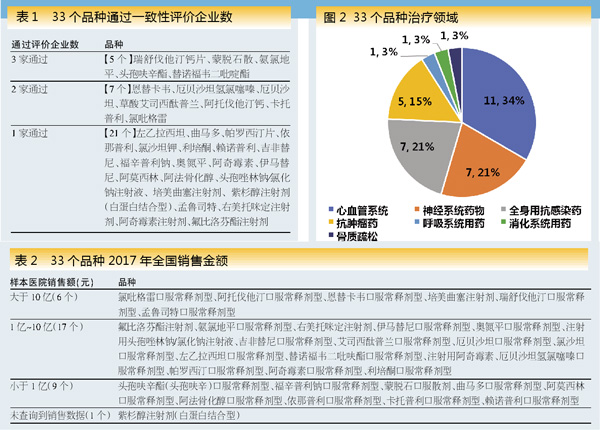
国家“带量采购”首批试点品种选取了33个通过一致性评价的品种,质量入围标准原则上亦以通过一致性评价为依据。33个品种中,有5个品种过评企业数为3家、7个品种过评企业数为2家、21个品种过评企业数仅一家。全部纳入了竞争剧烈的已有3家、2家通过评价的品种以及全部4种抗癌药。除右美托咪定注射剂外,均为医保药品(2017版国家医保目录)。33个品种包括6个注射剂、27个口服固体制剂。治疗领域以心血管系统(11个)、神经系统(7个)、全身抗感染(7个)用药为主(图2),此外还包括了目前通过一致性评价的全部4种抗癌药。
3.根据市场格局“分类采购”
根据竞争格局采购方式分为3类:满足入围资质企业达到3家及以上的,采取招标采购方式采购;入围企业为2家的,采取议价采购的方式;入围企业只有1家的,采取谈判采购的方式。企业数达到3家的为充分竞争,低价者中标预计价格降幅最大。仅1家的需要企业自主降价,因而预计价格降幅相对较小。
4.确保中标药品使用的激励约束机制
国家“带量采购”建立起了系统化的确保中标品种使用的措施。医保支付方面,对医疗机构医保年度总额预算不做调减,节约资金通过绩效考核等方式奖励医疗机构,为医疗机构使用中标品种提供经济激励。同时,以带量集采中标价格作为该产品通用名医保支付标准(统一支付标准),以鼓励患者使用。卫生健康部门监测并定期考核通报医疗机构的中标药品实际使用情况,考核结果在医疗机构等级评审、医保定点资格、国家及地方重点专科评定和复核、医疗机构负责人目标责任考核、以及医生职称评定、医保医师资格审核等事项中予以奖惩。从医院、科室、院长、医生、患者等角度,推拉结合保证中标品种的临床使用,防止发生上海第一批、第二批带量采购品种被替代的现象。
贰
国家集采“正式版”猜想
覆盖更多过10亿大品种
针对问题:带量采购品种选择标准未明确
目前国家“带量采购”品种选择标准尚未明确。根据对首批33个品种的分析,其全部纳入有3家、2家通过一致性评价企业的品种,可推测品种选择倾向于竞争充分者。
建议为扩大“带量采购”市场影响范围、提高患者获得感,品种选择应从销售量(金额)高、市场成熟的大品种中首先进行。根据PDB样本医院数据,首批试点的33个品种2017年全国销售额超过10亿元的仅6个;而目前57个过一致性评价品种中,2017年全国销售额超过10亿元的达到22个。
此外,“带量采购”品种选择时应兼顾覆盖目前一致性评价品种的全部治疗领域,提高不同疾病类型患者间的公平性。
质量入围指标、质量事件处罚进一步细化
针对问题:带量采购入围资质审核的内涵需要完善
国家“带量采购”药品入围标准考虑到“质量入围”和“供应入围”两方面因素。其中质量入围标准原则上以通过一致性评价为依据,考虑临床疗效、批次稳定性、不良反应等。供应入围标准主要考虑企业生产能力、供应稳定性等。这意味着国家“带量采购”参与企业为原研企业和通过一致性评价(含视同)企业,但具体入围资质有待细化。
而“带量采购”投标的一致性评价品种特别是新四类产品,本质上属于“首次上市的新品种”,真实世界中的安全性、有效性和生产中的工艺稳定性未得到足够时间的检验。加之“带量采购”模式下,中标品种将直接获得较大采购量,一旦出现质量、供应问题,后果将会很严重。
因此,除了国家方案中已经明确的质量、供应入围方案中提到的指标,可设置是否开展“产品定期安全性更新报告”“质量追溯体系”以及“国家质量公报无质量不合格记录,无GMP违规、无药品召回等情形”等质量入围评审指标,以及“原料药自产产量”或者“签订原料药采购协议”等保障原料药稳定供应的证明材料。
此外,还要明确对质量安全事件的惩处力度、提高企业违约成本,比如处以违约金额3~5倍违约金,或一年内取消该品种的投标资格,严重的暂停该品种所在企业的所有品种投标资格等。
对原研药执行省级差别化报销标准
针对问题:原仿“价差大”标准不明确,通用名医保支付落地问题
国家“带量采购”方案已明确提出以带量集采中标价作为该产品通用名医保支付标准(统一支付标准),在政策层面落实了按通用名支付。但也提出对原研药和仿制药价差大的产品,给予2~3年过渡期,逐步实现医保支付价趋同。
但是,“价差大”的量化标准尚不明确。33个品种中,原仿药价格比在1.5倍以内、1.5~2.0倍、2.0~3.0倍、3.0~4.0倍、4.0~5.0倍的分别占46.9%、25.0%、18.8%、6.3%、3.1%。由于集采方案中要求原研药和带量采购中标价格相差不得超过3~4倍,因而可以推测“价差大”的上限应为“带量采购”中标价的3~4倍,而原仿药价格比大于4.0以上的仅占9.4%,可能会在一定程度上降低按通用名支付政策的效果。
另外,2~3年过渡期内如何落实通用名医保支付标准,如何设置激励约束机制促使原研品种降价以缩小原仿药价差,过渡期后原仿药价差仍较大品种如何医保支付等问题,均未明确。
建议在国家层面明确“价差大”的具体定义,细化按通用名制定医保支付标准的实施条件。配合采购政策,对原仿药价差大的原研品种,通过限价、制定阶梯式报销比例等方式引导其合理降价。
此外,由于国家“带量采购”品种数量有限,大量品种没有国家集采中标价,且目前通过一致性评价的仅57个品种、97个品规,按通用名支付不具备全面实施的品种基础与价格信息。因此,建议将权限下放到省级部门,省级部门根据原研药的降价情况制定个体化的差别化报销标准。
政策鼓励对过评品种及时挂网、及时采购
针对问题:缺乏对一致性政策及产业发展的考量和牵引力
国家“带量采购”对于竞争充分药品实行“最低价独家中标”,将带来较大价格降幅,并极大促进仿制药替代。但是,国家目前的带量采购方案,缺乏对产业发展的考量,缺乏产业牵引力。如果按这个方案执行,多个通过一致性评价品种的内资企业竞争惨烈,除了中标企业外,其他药厂难以顺利回收成本,将导致继续参与一致性评价的积极性受到打击、一致性评价政策执行放缓,如此全方位提高仿制药质量的国家战略或将遥遥无期。
因此,建议鼓励通过一致性评价的品种及时挂网、医疗机构及时采购的激励政策,让企业有时间回收成本。之后通过定期带量采购竞争降低药品价格。
总结<<<
国家“带量采购”试点是2001年308号之后第一次真正意义上的“带量采购”。以“质量和疗效一致”为投标基础条件,在保证稳定供应的前提下,最低价者独家中标,获得全国近20%的市场,通过医保支付、绩效考核等建立起中标品种使用激励约束机制,保证政策顺利落地。
在国家“带量采购”模式下,相较于原研品种,通过一致性评价仿制药更容易中标,会在一定程度上促进仿制药替代进程。但是,其对一致性评价政策的继续推行及仿制药产业发展缺乏支持和考量。
目前国家集采方案尚未正式出台,诸多采购细节尚未明确。未来政策执行效果更多依赖于省级采购、医保支付、临床使用等环节的配套政策的制定和执行。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



