原研替代加速 仿制药分食巨大市场
发布时间:2018-10-30 12:43:30作者:本报特约撰稿 张自然来源:医药经济报
日前发布的《国务院办公厅关于改革完善仿制药供应保障及使用政策的意见》,提出了明确的激励政策。例如,对于通过一致性评价的产品,要及时纳入采购目录,药品集中采购机构要按药品通用名编制采购目录,促进与原研药质量和疗效一致的仿制药和原研药平等竞争,还要促进仿制药替代使用。
同时,相关部门要发挥基本医疗保险的激励作用。加快制定医保药品支付标准,与原研药质量和疗效一致的仿制药、原研药按相同标准支付。通过医保支付激励约束机制,鼓励医疗机构使用仿制药。
笔者认为,加速仿制药替代原研,是降低药费支出的一条理想路径。对此,本文详细梳理了相关数据与一致性评价的相关进展。
美国 仿制药控费的国际经验
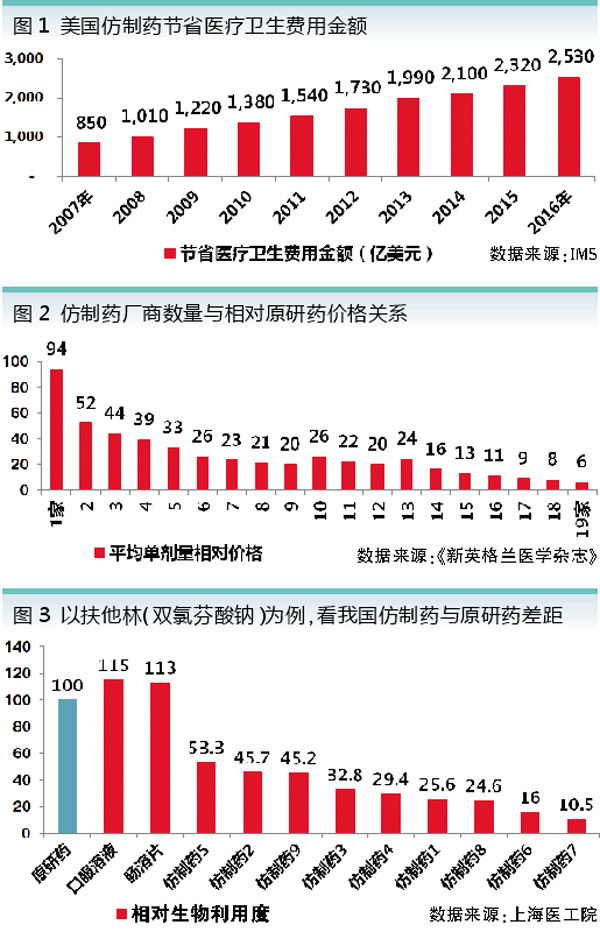
美国药品研发能力很强,但同时也是全球最大的仿制药市场,据IMS统计,2013年全球1600亿美元仿制药市场,美国就占了500亿美元。过去10年,仿制药为美国医疗卫生体系共计节省了1.67万亿美元(见图1)。
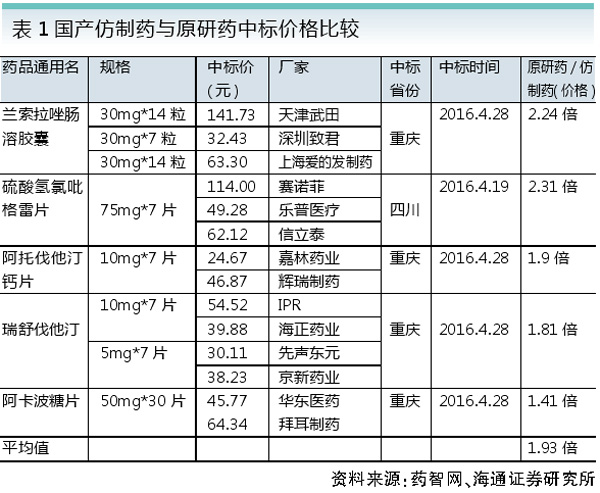
研究显示,仿制药的价格将随着参与仿制药生产企业数量的增多而相应下降,当处于2~5家竞争时,价格迅速下滑到33%~52%,竞争厂家多了,则价格将降得更低(见图2)。
为何我国的仿制药没能替代原研药及过期专利药从而降低药费支出呢?笔者分析,主要有以下两个原因:
1.质量差异
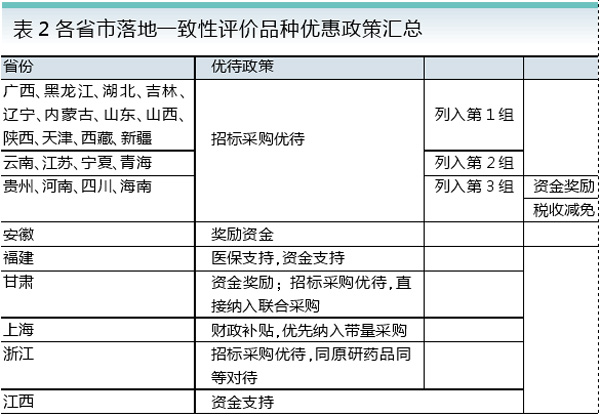
长期以来,我国的仿制药质量与原研药有着巨大差距,也就不可能像国外仿制药那样替代原研药,从而降低药费支出。以扶他林(双氯芬酸钠)为例,国产仿制药的生物利用度与原研药存在较大差异(见图3)。
2.招标层次
招标时,国产药与原研药及过期专利药不能在同一质量层次,原研及过期专利药价格也就难以降低(见表1)。
中国 原研替代时代开启
笔者认为,发展仿制药的途径基本有两个,首先对存量批文进行一致性评价,同时加速仿制药的研发。
一致性评价进展汇总
1.已通过一致性评价的品种
截至目前,已通过一致性评价的共15个品种(22个品规),其中289目录外的品种达10个(17个品规),可见企业看到了一致性评价的市场潜力,主动加速了一致性评价的进程。国务院和CFDA在多个重磅文件中都提出对通过一致性评价的品种给予医保支付、招标采购、资金支持三个方面的优待,目前绝大多数省市也已出台落地一致性评价优惠政策(见表2)。
2.注射剂一致性评价
2017年12月22日,CDE发布了《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》,2018年3月13日CDE又发布了《药物注射剂研发技术指导意见》,将注射剂一致性评价提上了议事日程。和口服固体制剂相比,注射剂覆盖范围更广,涉及企业也更多。2016年我国注射剂用药规模达7577亿元,临床使用的西药中注射剂超过了70%。
事实上,已有多家企业提前在做注射剂一致性评价相关准备工作。截至2017年11月20日,拟进行一致性评价的注射剂品种有66个(见表3),提出注射剂参比制剂备案的企业已有52家(见表4)。
原研替代市场空间巨大
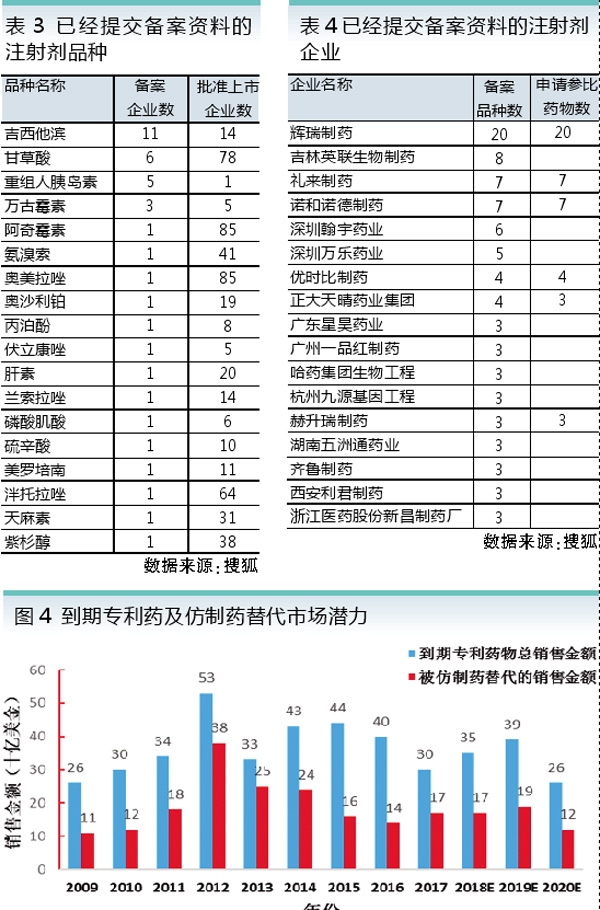
今后一段时间,将有多个药品专利到期,有巨大的市场空间供仿制药替代(见图4)。
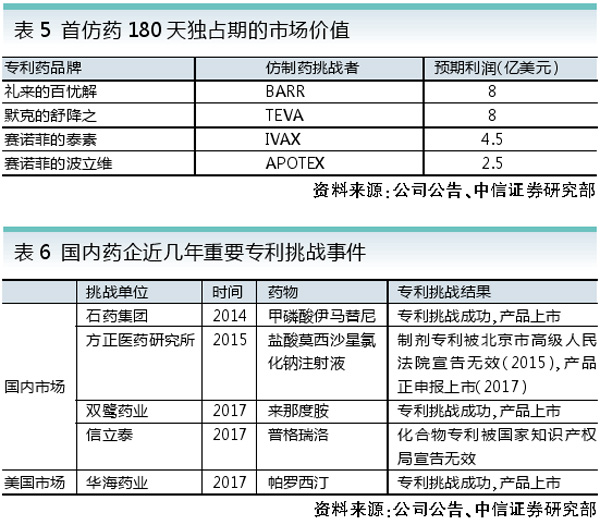
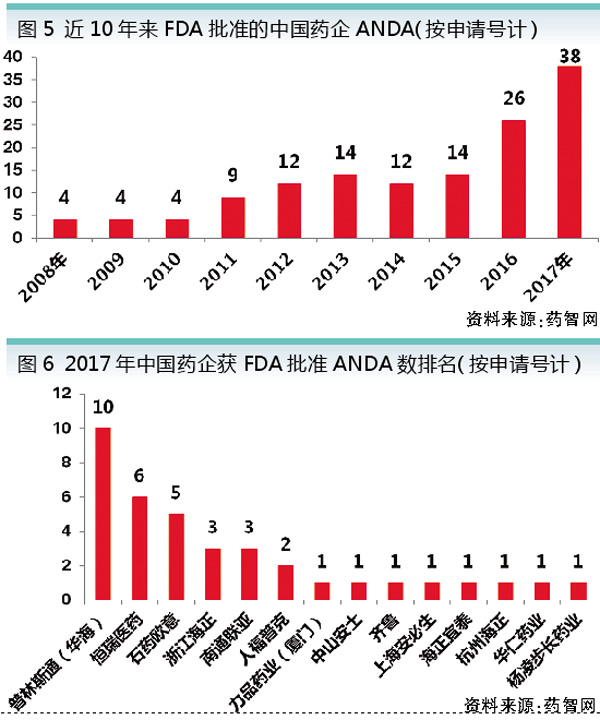
对尚未上市的在研仿制药而言,完善专利制度是关键。2017年10月8日中办国办发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(42号文),提出了完善专利制度的具体措施,具体包括建立上市药品目录集、探索建立药品专利链接制度、开展药品专利期限补偿制度试点、完善和落实药品试验数据保护制度等。
通过列出专利和独占信息,保护专利权人合法权益,降低专利侵权风险,从而促进仿制药研发的积极性。
2017年12月29日,首版《中国上市药品目录集》发布,共收录了131个品种,203个品种规格,其中包括通过仿制药质量和疗效一致性评价的13个品种(17个品规)。CFDA将对新批准上市的新注册分类药品以及通过仿制药质量和疗效一致性评价的药品直接纳入《中国上市药品目录集》,实时更新。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



