保障儿药安全 还可以做些什么
发布时间:2018-10-26 18:30:58作者:王淑玲 李丽来源:医药经济报
我国医药行业的快速发展与“二孩”政策的实施,使得儿童用药安全话题的热度持续升温。
推进立法的重要性
我国儿童药物临床研究起步较晚,早在2003年8月,主管部门发布了《药物临床试验质量管理规范》,将儿童纳入药物临床试验对象,但规定儿童作为受试者时必须取得其法定监护人的知情同意并签署知情同意书,当受试儿童能作出是否参加研究的决定时,还必须征得本人同意。
2011年8月,为进一步加强孕产妇及儿童临床用药管理,保障孕产妇及儿童临床用药安全,国家卫生部门发布了《关于加强孕产妇及儿童临床用药管理的通知》,要求医疗机构针对孕产妇及儿童建立药物遴选制度,加强处方权及调剂资质管理,规范药物临床应用管理,加强处方和医嘱点评工作。至2014年5月,多部委联合印发《关于保障儿童用药的若干意见》,这是我国关于儿童用药的综合性指导文件,对儿童用药价格给予政策扶持,儿童专用剂型可单列代表品,不受成人药品定价水平影响;发挥医保对儿童用药的保障功能,按规定及时将儿童适宜剂型、规格纳入基本医疗保险支付范围。2015年9月,《关于进一步加强医疗机构儿童用药配备使用工作的通知》出台,对医疗机构儿童药品的使用进行了进一步的规范。2017年5月,主管部门紧密围绕我国儿童疾病谱以及相关企业研发生产能力,联合发布了《关于印发第二批鼓励研发申报儿童药品清单的通知》,鼓励企业研发并申报儿童适宜品种的药品,以满足儿科用药需求。
可以看出,我国对儿童用药安全问题越来越重视,但儿童用药法规体系还有进一步完善的空间。
规范建议
1.实现量的变化
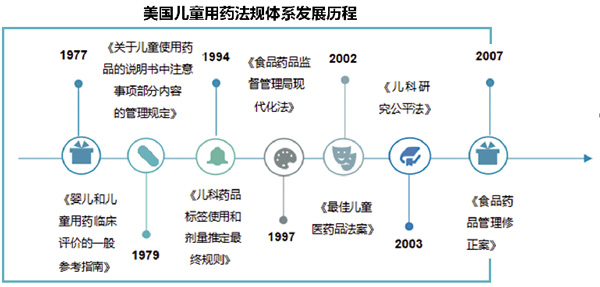
美国在20年前确立了“儿科独占”的激励儿童药品研发的法律制度,延长了儿科药品专利独占保护期。其《儿童最佳法案》则为药品生产商提供了经济上的支持。这些法规体现了政府对药品生产商的鼓励,提高了药品生产商对儿童临床试验的积极性。
我国的药品研发模式以仿制药为主,儿童药品临床试验研究相对不充分,缺少儿童临床试验数据。在现有政策法规前提下,我们还需要更多地对药品生产商进行儿童临床试验实行鼓励政策。继续加大对药企在资金、技术方面的支持,提高源头药企的积极性,同时对药企行为进行合理的规范。并建议建立专业的儿童药品临床试验基地,提高儿童药品研发生产的专业性和创新性。
2.实现质的飞跃
仅有鼓励政策是无法有效规范儿童用药的。美国曾发布《儿童研究平等法案》,强制性规定对药品和生物制品的新有效成分、适应症、剂型、给药剂量或途径等提出的新药申请或补充申请。该法案授予FDA强有力的监管权,使得药品审批过程更加公平与透明。这种软硬兼施的做法实际都为了一个共同的目标——提供新的儿童药物信息和药品标签,鼓励药企进行儿童药品临床试验,在儿童用药方面取得了良好的成效。
我国在继续加强对儿童用药的监管力度,合理规范药品生产商行为的基础上,建议是否能赋予主管部门对儿童用药研究监管的权利,并专门开设儿童用药审评中心,对部分新药上市强制性要求开展儿童临床试验研究,建立评估必须的具体指标,以进一步确保儿童药品的安全性。同时给予儿童药品专利独占保护期,保护药企权益。
3.提高信息透明度
建议在法律允许的范围内公布有关儿童药品各个方面的信息,提高药品信息透明度。由于我国在儿童安全用药方面起步较晚,还需借鉴发达国家成长经验,加强国际交流,根据国情选择最适合的中国方案。
(本文作者来自沈阳药科大学工商管理学院)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



