药品说明书修订潮起
发布时间:2018-10-24 16:28:07作者:本报特约撰稿 边界来源:医药经济报
药品说明书修订潮起
以儿童药限制、中药注射剂为两大主要方向;其中,中药注射剂重点关注过敏反应
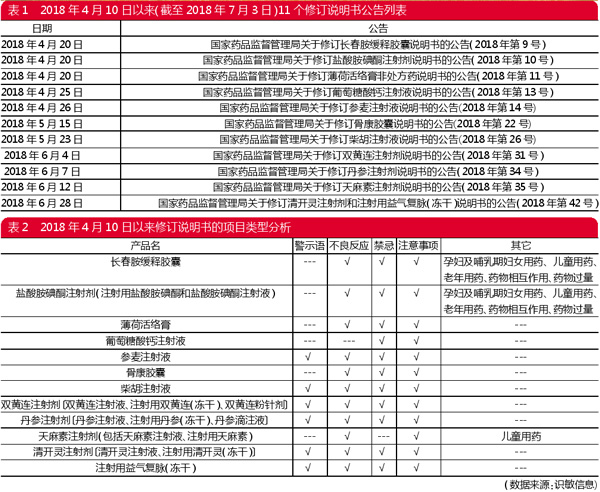
从2018年4月10日国家药品监督管理局发布《国家药品不良反应监测年度报告(2017年)》以来,至2018年7月3日,国家药品监督管理局共发布了11个修订说明书,其中6个是中药注射剂。
在不到三个月的时间内,有关修订说明书的公告发布可以说是比较密集了。笔者对这些修订说明书公告进行分析,寻找目前修订说明书的主要方向和用药风险的主要环节。
【大趋势】 更多产品说明书修订公告
国家药品监督管理部门根据药品不良反应监测数据和评估结果,将对发现存在安全隐患的药品及时采取相应的风险控制措施,以保障公众用药安全:
1)召回和暂停销售的公告:2017年发布了红花注射液和喜炎平注射液2个产品召回和暂停销售的公告。
2)《药品不良反应信息通报》通报药品风险,及时提示用药安全风险:2017年发布通报3期,通报了关注麦考酚类药品的生殖毒性风险、关注甲氨蝶呤片的误用风险、关注含钆对比剂反复使用引起脑部钆沉积的风险。
3)发布说明书的修订公告:2017年注射用氨曲南、麦考酚类药品、复方甘草口服溶液、复方氨基酸(18AA)、复方脂溶性维生素注射剂等47个/类药品的说明书被修订。
4)发布《药物警戒快讯》,提示国外药品安全信息:2017年共发布12期,涉及50个(类)品种包括来那度胺、阿普斯特、左乙拉西坦等。
由此看来,根据药品不良反应的监测数据修订产品说明书加入安全性信息,更新药品如何安全使用的信息等公告会越来越多。
【风向标】 中药注射剂重点关注过敏反应
从修订说明书的项目类型来看,如表2所示,不良反应、禁忌和注意事项是经常被修订的项目。除了天麻注射剂以外,其余5个中药注射剂被要求增加警示语,其内容主要为“不良反应包括过敏性休克,应在有抢救条件的医疗机构使用,使用者应接受过过敏性休克抢救培训,用药后出现过敏反应或其他严重不良反应须立即停药并及时救治”。由此可侧面反映出,中药注射剂不良反应/事件报告总体以过敏反应为主。
[修订重点1] 儿童药限制
注射剂在特殊人群中使用风险相对较高,特别是儿童口服用药依从性差,使用注射剂相对较多。2017年儿童药品不良反应/事件报告涉及的药品剂型分布中,注射剂占83.5%、口服制剂占12.7%、其他制剂占3.8%。由于儿童脏器发育尚未完全,对药物更为敏感,耐受性较差,儿童注射用药风险值得关注。
近期发布的11个公告涉及12个/类产品中,有8个/类产品在儿童用药方面受到限制,分别是盐酸胺碘酮注射剂、薄荷活络膏、柴胡注射液、双黄连注射剂、天麻素注射剂和丹参注射剂、参麦注射液、清开灵注射剂。
鉴于盐酸胺碘酮在儿童患者中用药的安全性和有效性尚未建立,盐酸胺碘酮注射剂不推荐儿童用药。此外,注射用胺碘酮含有苯甲醇,有新生儿(出生不满1个月的婴儿)在静脉给药后喘息综合征致命的报道。由于未进行儿童用药有效性和安全性研究从而儿童慎用的还有天麻素注射剂。
限制岁数使用的有薄荷活络膏和双黄连注射剂。薄荷活络膏对两岁以下少儿禁用;双黄连注射剂对4周岁及以下儿童、孕妇禁用。
柴胡注射液为儿童禁用。丹参注射剂、参麦注射液、清开灵注射剂则为新生儿、婴幼儿禁用。
2017年儿童药品不良反应/事件报告中,中药占12.7%,排名前3位的是清热剂(38.0%)、解表剂(18.0%)、开窍剂(15.8%)。本次限用儿童使用的柴胡注射液、清开灵注射剂和双黄连注射剂就属于清热解表类药物。预计说明书调整对治疗感冒等的发热药柴胡注射液、清开灵注射剂和双黄连注射剂的市场冲击最大。
[修订重点2] 中药注射剂
中药注射剂还关注组分中可能引起的过敏原。
例如参麦注射液的红参、麦冬,注射用益气复脉(冻干)的红参、麦冬、五味子,双黄连注射剂的黄芩、金银花、连翘,清开灵注射剂的胆酸、珍珠母(粉)、猪去氧胆酸、栀子、水牛角(粉)、板蓝根、黄芩苷、金银花。
对个别中药注射剂的使用,还要求严禁混合配伍,谨慎联合用药。
中药注射剂大多提倡单独使用,禁忌与其他药品混合配伍使用。如确需要联合使用其他药品时,则需要谨慎考虑注射的间隔时间以及药物相互作用等问题,输注两种药物之间须以适量稀释液对输液管道进行冲洗。
对个别中药注射剂要求加强用药监护。用药过程中密切观察用药反应,特别是开始30分钟,发现异常应立即停药,采用积极救治措施救治患者。
此外,葡萄糖酸钙在水中的溶解度约为3.3%,故国内已批准的注射液的2ml:0.1g、10ml:1g和10ml:0.5g,三个规格都为过饱和溶液,可能会出现结晶现象。葡萄糖酸钙注射液的结晶问题在注意事项中列明。虽然国外同品种说明书中提出如有结晶,水浴加热复溶后可使用,但说明书目前暂不推荐结晶后使用。
小结<<<
药品生产企业、经营企业和医疗机构是药品不良反应报告的责任单位。按照报告来源统计,2017年来自医疗机构的报告占88.0%,来自药品经营企业的报告占9.9%,来自药品生产企业的报告占1.8%,来自个人及其他的报告占0.3%。
随着国家进一步强化药品上市许可持有人主体责任,推动建立药品上市许可持有人直接报告药品不良反应制度,预计未来不良反应来自药品生产企业的报告会越来越多,对应的说明书修订也将越来越规范化。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



