优先审评券为什么这么火
发布时间:2018-10-16 14:35:33作者:廖联明来源:医药经济报
优先审评券是FDA为鼓励制药企业开发某些热带疾病和罕见儿科疾病药物所推行的一种鼓励项目。凡按照优先审评券疾病清单成功上市相关药物的企业,均可以获得一张优先审评券。公司可自己使用优先审评券,也可转让出售给其他公司。使用优先审评券的新药上市申请享受6个月内完成审评的福利(标准审评的周期为10个月),从而抢得上市先机。2009年FDA颁发出第一张优先审评券。
双向提升研发动力

优先审评券可提升两种低效情况:一是鼓励对被忽视的和罕见疾病治疗新药的研究,二是通过使用或转让优先审评券加快潜在重磅级药物在美国的上市速度。
然而一种药物的审评速度加快,可能意味着减慢其他药物的审评速度。为保证FDA有足够的审评力量,优先审评券使用者必须向FDA支付额外的审评费(2017年每张为270.6万美元)。因此,如果FDA每年颁发4张优先审评券,就可稳定获得额外的1000万美元进账,用于雇用更多审评员。
一个重要的亮点是,优先审评券可以转让。例如,一家小公司可能因开发某种药物而获得一张优先审评券,但该公司没有后续的研发项目,因此没有使用优先审评券的机会。这时它可以把优先审评券卖给另一家大公司,用于开发更有商业前景的药物。这样小公司可以从转让费中获利。
优先审评券计划提高了投资者投资那些从事被忽视疾病药物研发企业的动力。
例如,NanoViricides公司正在开发在美国等市场销售潜力巨大的抗病毒药物。其CEO Eugene Seymour博士介绍,为了获得优先审评券,他们现在正在开发一种治疗登革热的药物,目的是为抗病毒药物争取一张优先审评券。Seymour博士与许多不同的机构进行了认真的讨论,其中包括美国疾病控制中心的登革热部门的负责人,后者承诺支持他们的临床试验。他们也和美国南方一家大型基金进行了交流,后者希望获得该药的销售权。而如果没有优先审评券计划,这些情况都不会发生。
同样的,全球卫生投资基金已经宣布向澳大利亚非营利药物开发商Medicines Development提供1000万美元资金,用于完成治疗河盲症(盘尾丝虫病)的莫昔克丁(moxidectin)在美国的新药注册。由于河盲症不会影响富裕国家,该药的销售量一直在下降。如果该药能获得批准,将有助于加速根除河盲症。此外,基金公司将从转让优先审评券中获得部分回报,吸引完成莫昔克丁开发最后阶段所需的资金。
交易价一路攀高
要获得优先审评券,需要满足三个条件:一是成功上市优先审评券疾病清单的治疗药物(详见表2),优先审评券疾病清单是动态的。二是不包含任何其他FDA已经批准的活性成分(包括任何活性成分的酯或盐)。三是研发的新药本身具有获得优先审评的资格,即该新药在疗效方面有重大突破,或者针对的疾病目前尚无有效的治疗手段。换句话说,要使用优先审评券,该新药必须首先具有优先审查的资格。
优先审评券的价格取决于供求关系。三个因素决定了优先审评券所具有的价值:可更早开始新药销售的时间;是否延长专利有效时间;较竞争对手更早进入市场带来的销售量多大。
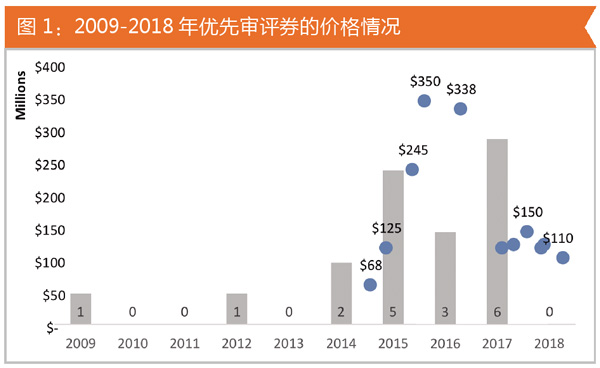
一个重磅炸弹药物每年可有数十亿美元的销售额,因此提前几个月获得批准可带来数亿美元收入。2014年,赛诺菲/Regeneron以6750万美元购买了第一张优先审评券。2015年,赛诺菲再次以3.5亿美元购买优先审评券。2015年,欧洲药监局在赛诺菲/Regeneron公司的Praluent上市之前两个月批准了安进公司的降胆固醇药物Repatha。但是,在美国由于赛诺菲/Regeneron使用了优先审评券,因此Praluent比Repatha还提前一个月上市。
2017年,有5张优先审评券的价格在1.25亿~1.5亿美元之间。对于新药开发来说,时间是宝贵的,优先审评的资源是稀缺的,因此优先审评券价格一路攀高。图1显示了优先审评券从2009年到2018年的价格走势。
优先审评券没有使用期限,但纳入清单的疾病谱是动态的。尤其是针对被忽视疾病的优先审评券(2007年开始)还在进行中,而儿科罕见疾病项目将于2020年10月结束。但如果某药物是在2022年10月获得批准,而且是认定为儿科罕见病治疗的药物,仍可获得优先审评券。而且审查优先审评券项目到期还可以向国会申请延期。
优先审评券也有局限性
对于优先审评券获得者而言,相关政策的不足之处在于:
首先是有关“在其他国家已有、但没有在美国注册上市的药物也有资格获得优先审评券”。有人呼吁美国国会对此条款进行修改,如排除在美国以外的地区上市使用超过3年的药物。这些药物在美国注册上市的好处是,这些药物可被纳入美国医疗商业保险,美国士兵在外有机会使用这些被忽视和罕见疾病药物。
二是认为优先审评券的奖励可能还不够大,特别是对于治疗一些负担极重的疾病药物,应该给予更多的支持。
三是这个奖励并不意味着病人可以免费获得相应的新药,因此可能需要政府或基金会的资金来为穷人购买治疗药物。
对优先审评券使用者而言,不足之处在于:
一是优先审评券计划可能会很大程度占用FDA资源。对此,已有法律规定制造商要向FDA支付额外费用,并要求持券人在使用优先审评券前90天告知FDA。
二是优先审评也并非万无一失。优先审查不应与加速审评或快速审评相混淆。优先评估也不能忽略安全性或有效性研究,或在规定的时间范围内要求批准。虽然规定FDA审查周期是6个月而不是标准情况下的10个月左右,但如果FDA审评员感到6个月完成审评有压力的话,有可能超时。
三是增加保险公司代价。提前4个月上市,意味着保险公司提前4个月开始支付治疗费用。使用这些药物本身会增加社会成本,因而需要估量病人获益是否大于社会成本。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



