药物警戒体系管理待升级
发布时间:2018-10-15 14:36:38作者:本报记者 张蓝飞来源:医药经济报
满足临床急需利好不断
国家药品监督管理局、国家卫健委上周联合发布《关于优化药品注册审评审批有关事宜的公告》(2018年第23号),对防治严重危及生命且尚无有效治疗手段疾病以及罕见病药品,CDE将建立与申请人之间的沟通交流机制,加强药品研发指导,对纳入优先审评审批范围的注册申请,审评、检查、审批等各环节优先配置资源。
深化落实药品优先审评审批工作机制,为临床急需、显著临床优势、严重危及生命、罕见病等未被满足的临床需求提供了高效的药物优先审评路径,有助于全行业优化创新资源。一方面,科学审评加速审批成果显现;另一方面,临床急需创新药物快速上市,对药物安全的上市后监控必将带来全新考验,搭建完善的药物警戒(PV)体系并进行高效管理势在必行。
PV监测主动出击
早在2011年,《药品不良反应报告和监测管理办法》(卫生部令第81号)中就增加了“药品重点监测的要求”,对生产企业主动开展监测工作提出了更高标准,其中第六十三条明晰了药品重点监测的定义,“进一步了解药品的临床使用和不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等,开展的药品安全性监测活动。”去年10月“两办”印发的“三十条”,也明确包括罕见病治疗药品和器械的创新鼓励政策,如可附带条件批准上市等。同时强调应建立药品上市许可持有人直接报告不良反应和不良事件制度。
以西达本胺为例,深圳微芯生物科技有限责任公司药品安全总监王欣昊告诉记者,该药获批的首个适应症是外周T细胞淋巴瘤(PTCL),流行病学统计患病率约为90/百万,属罕见病范畴。按照81号文要求:药品生产企业应当考察本企业生产药品的安全性,对新药监测期内的药品和首次进口5年内的药品开展重点监测;对本企业生产的其他药品,根据安全性情况主动开展重点监测。
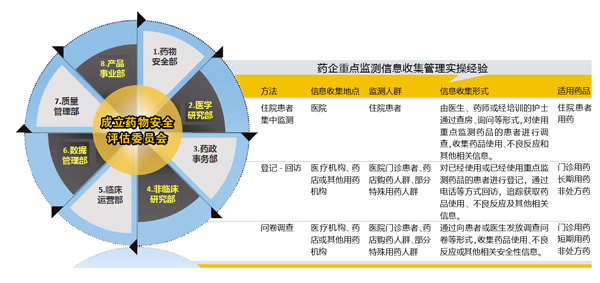
据悉,上述企业于2015年3月对该药正式启动了主动监测(重点监测),搭建了跨部门的药物警戒架构:成立药物安全评估委员会(PSRC),由公司负责临床开发的首席医学官担任PSRC主席。在PSRC之下,分设药物安全部、医学研究部、药政事务部、非临床研究部、临床运营部、数据管理部、质量管理部、产品事业部。具体的风险管理措施上,在药品中附上“患者服药日期卡”,印制“自发报告管理流程卡”。还建立了三级文件体系:包括不良反应上报和监测管理制度一级文件,文档创建、批准、存档管理、数据库管理等操作规程和SOP二级文件,以及记录表格和工作指南等三级文件。
通过制定系统的监测方案和信息收集计划,主动收集与重点监测药品使用相关的安全性信息,再对收集的信息进行统计分析和评述,是目前国际通行的药品不良反应(ADR)主动监测方式。以美国FDA为例,主动监测使FDA可以利用相关机构已有数据对药品安全性进行分析,避免了各种瞒报、漏报行为。该系统数据来源广泛,遍布全美多个数据提供方(包括保险公司、制药企业、医学院、药学院、综合或专科医院等),使得FDA从提出安全性问题到得出结果的时长大大缩短,效率大大提升。
重点分析“安全信号”
新的政策环境下,临床急需药物上市快车道逐步构建,创新药企业完善PV管理体系,针对重点品种开展主动监测势在必行。
在近日由广东省医药合规促进会主办的“制药企业药物警戒体系的建立与实时操作高级培训班”上,CIO合规保证组织、国健医药咨询CEO谢名雁告诉记者,“上市前临床研究依然存在较多现实局限,如患者人群研究样本量有限,研究人群窄,不包括老人、儿童、妇女等特殊群体,适应症较为聚焦或有意排除某些疾病状态,持续时间无法反映药品潜在的长期使用状况等。”
现实情况是,绝大多数企业将ADR管理纳入GMP管理,制定的内部程序和规程基本涵盖监管要求。与此同时,有任务、无标准的问题普遍存在,各项SOP流于形式,缺乏操作规程和可参考的执行标准,落地缺少时限、衔接、质控等关键内容,直接影响个例报告、上市药品定期安全性更新报告(PSUR)等工作的时效与质量。
对此,广东省药物不良反应监测中心主任邓剑雄指出,有些企业信息化水平较低,ADR信息管理方式粗犷,缺乏数据库的规范建立;不具备信号识别、分析、评价的方法和能力;企业主动开展安全性研究不够多,针对风险进行控制和管理的手段不够丰富,最终令主动监测的措施不得力。
换而言之,企业必须高度关注临床前研究、临床研究、常规监测中发现的药品安全性信号,以及同类产品(相同活性成分/组方、相同作用机理)可能存在的严重类反应。
美国G2生物医药服务公司总裁杨春旭在会上表示,一旦出现安全信号,必须判断安全信号和ADR之间的因果关系。“重点关注临床病例报告、数据挖掘和数据库定期自动筛选的结果,及时对安全信号进行验证,结合已知风险或文献病例报道、试验证据、生物作用机制等资料判断临床意义,综合评定所有能够得到的安全信息数据。”邓剑雄也指出,出现安全信号提示,需做进一步调查,主动开展有关药品安全性的各项研究。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



