十年省540亿美元! 生物类似药先要过四关
发布时间:2018-09-30 15:58:45作者:廖联明 黄静来源:医药经济报
十年省540亿美元!
生物类似药先要过四关
近年来,各国医疗成本都在持续增加,特别是抗癌药的费用更是突飞猛涨,促使各国有关方面都在寻找控制医疗成本的新战略。
在过去二十多年里上市的抗癌新药,有很大一部分是生物制剂,其价格的增长速度更快,因此当务之急是控制生物制剂的价格。开发生物类似药是其中最有效的办法。
兰德公司(RAND)最近的一项分析估计,生物类似药的上市可能会使全球2017-2026年的医疗支出减少540亿美元。
【四大挑战】
1.认知挑战
迄今为止,FDA已批准9种生物类似药上市,包括filgrastim-sndz(仿制安进公司的Neupogen)。
然而,要让医生和患者接受生物类似药,仍存在一些挑战,因为供应商、保险机构和患者对生物类似药的安全性和有效性的理解和接受度有待提高。
生物类似药获得上市批准的主要条件是临床前研究。临床医生对这些产品有效性的认识只能根据临床前药理学数据,而不是大型随机临床试验。此外,目前关于生物类似药的应用指南和报销政策等方面,仍存在很多混淆和不确定性。
为了向临床医生提供生物类似药的指导,美国临床肿瘤学会(ASCO)最近发布了一份声明,对生物类似药的命名规则、说明书、安全性和有效性、互换性等内容进行了说明。该声明强调对临床医生和患者进行相应教育的必要性,以建立他们对生物类似药安全性和有效性的信心,提高使用率。
2.生产挑战
治疗性蛋白质包括细胞因子(例如重组人促红细胞生成素)和单克隆抗体(例如贝伐珠单抗),它们是通过细胞表达的,而不是化学合成。
生产生物类似药首先需选择特殊的细胞系,用于转入基因和载体,产生目的蛋白质。生物类似药必须具有与参比制剂相同的氨基酸序列,但由于蛋白质的翻译后修饰、糖基化或制剂工艺不同(例如,使用不同的赋形剂),使得两者可能存在小的差异。药厂需要提供足够的数据证明这些差异不会影响临床疗效。
蛋白质的折叠方式和结构的微小差异理论上可能使其药理作用和免疫原性发生改变。因此从本质上讲,要生产出与参比制剂相同或完全等效的蛋白质是不可能的。事实上,即使是使用相同细胞系生产的不同批次的同一参比制剂,其功效也可能有微小的差异。
因此,审评机构要评估生物类似药和参比制剂在每一生产步骤上的差异,以确定这些差异对药品安全性和有效性的潜在影响。临床前研究通常包括蛋白质结构和功能的分析研究,蛋白质在动物模型中的活性和毒性评估,药代动力学、药效学和免疫原性研究,结合力、交叉反应性、免疫原性和补体结合反应以及在各种条件下的稳定性。必要的话,会要求药厂进行临床研究。
3.审评挑战
生物类似药的审评制度与仿制药或生物制剂的原研药不同。在生物制剂的原研药上市审评过程中,虽然分子结构鉴定和临床前数据十分重要,但支持它们上市的主要数据来自临床试验。相比之下,生物类似药的审评更侧重于分子结构鉴定和临床前研究。
FDA要把握生物类似药的任何不确定性。审查每一个生产步骤,并对整体证据进行评估,从而确定是否需要进一步研究,以消除生物类似药和原研产品之间任何有关共同点上的不确定性。如果存在不确定性,则需进行两者的临床剂量范围、功效和安全性比较研究。
生物类似药的上市批准申请无需包括适应症的重复试验,并且获得批准的生物类似药的药品说明书内容可能与其参比制剂相同。这是推动生物类似药发展的一大动力。
4.原研药阻击
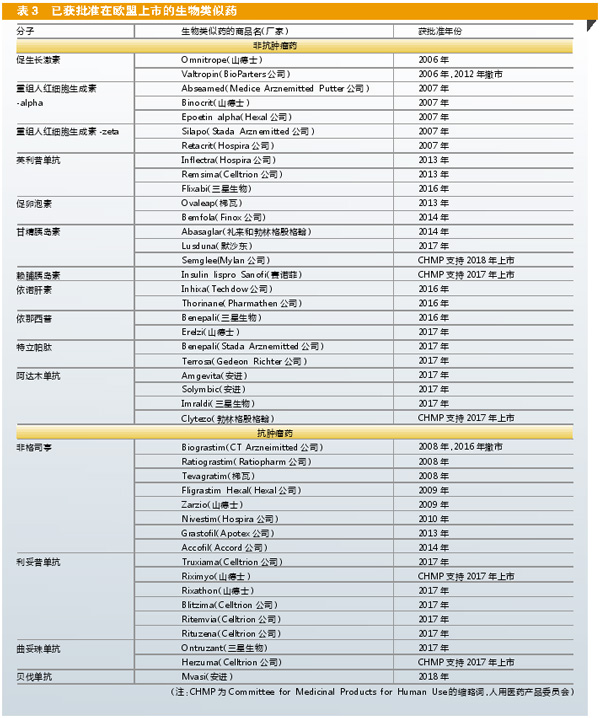
目前欧洲药品管理局(EMA)已批准了40种生物类似药,其中15种用于抗肿瘤(见表3)。
但获批上市的生物类似药不一定能实现商业化,因为原品牌药厂家经常利用专利侵权诉讼延迟生物类似药的市场推广。另一种拖延战术是拒绝向开发生物类似药公司出售原品牌药,使得它们没有足够的对照药品进行临床比较试验,但原品牌药厂家的这种做法可能很快就会被立法限制。
【“解锁”进行时】
命名规则、说明书
和上市后监测
生物类似药的命名方法是依照国际非专利药命名规则,再加一个无任何意义的4字母后缀,在处方书写和上市后安全监测时可凭借这个后缀识别生物类似药。
生物类似药的说明书则包括该药与参比制剂的比较结果。
而生物类似药上市后的监测报告特别重要,因为任何一个生产过程的差别都可能导致药品的安全性差异,尤其是免疫原性差异。
可互换性
可互换性是指可在治疗过程的任何阶段用生物类似药代替其参比制剂,并发挥等效的临床治疗作用,病人的安全性风险也没有增加。迄今为止,还没有生物类似药在美国被批准为完全可互换性产品。可替换性生物类似药的非专利药命名规则是否区别于那些被视为不可互换药品的命名规则还有待商榷。
随着越来越多生物类似药被批准用于代替特定的参比产品,以及生产商为寻求竞争优势,可互换性的概念将会变得越来越重要。
更便利的上市后
安全登记系统
由于生物类似药的上市批准对临床研究要求少,因此FDA和临床医生主要依靠生物类似药的上市后数据来评估它们的安全性和有效性。但许多临床医生认为目前的药物上市后不良事件报告系统的使用过于复杂,受时间的限制,他们不愿意参与不良事件的监测。
不过,现在有很多系统可用于收集药物的真实世界临床数据,包括FDA警戒行动(Sentinel Initiative)、上市后安全登记系统以及ASCO CancerLinQ系统。
报销政策支持力
目前,美国医疗保险和医疗补助服务中心已明确规定,同一参比产品的全部新生物类似药都将单独编码,并将根据以下原则进行报销:生物类似药的平均售价+原品牌参比产品平均售价的6%。此外,根据Medicare的处方药计划(Part D),生物类似药不纳入折扣计划,而要求生产商为品牌药和品牌生物药提供50%的折扣。

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



