揭密改良药中美“双报”黑盒子
发布时间:2018-09-30 15:26:41作者:本报特约撰稿 边界来源:医药经济报
仿制药竞争激烈,企业纷纷布局改良药寻求差异化,其中最令人眼热的“双报”捷径到底好不好走?
化学药品注册改革自2015年启动,至今相关政策已基本明朗。
仿制药政策推动下,仿制药热门产品10家企业以上启动BE研究的事件时有发生。以恩替卡韦片为例,2016年以来在CDE登记BE研究的就有重庆药友、北京百奥、信泰制药、湖南千金湘江、齐鲁制药、浙江华圣、上海国创、湖南天地恒一、广东东阳光、广州玻思韬、扬子江药业和上海诺华12家企业,此类产品预计将会很快陷入价格战。
专利过期的原研药面临一致性评价的冲击,医院招标采购的质量层次与按质量一致性评价要求生产的仿制药一样,必然会随着质量与原研一致的仿制药生产厂家数获批增多而竞争强度加大,导致专利过期的原研药降价和市场被替代的压力增加。
由此可见,我国化学药品的市场规模发展趋势将越来越像欧美,仿制药的利润将受限于竞争厂家数。国内寻找差异化的企业除了布局1.1类新药,改良药的热潮也开始兴起。
旧申报能否侥幸过关?
难逃国内注册新改革关
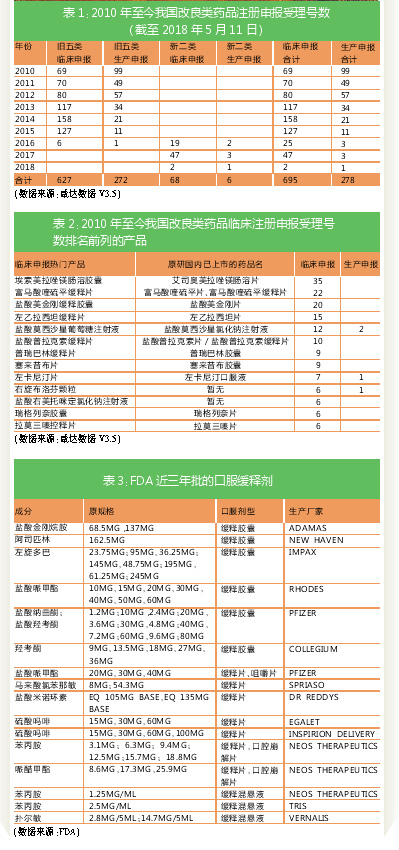
如表1所示,截至2018年5月11日,我国改良药的临床申报受理号数和生产申报受理号数比例约为2.5:1。2013年起,改良药的临床申报受理号数过百。2014年,由于审评积压,临床申报受理号数和生产申报受理号数比例较2013年翻倍。2015年面临审评积压和临床自查核查,比例上升到11.5:1。2016年,由于注册法规不明朗,临床申报受理号数和生产申报受理号数双双下滑。2017年以后,改良药的申请都是按新2类申报,临床申报受理号数有所回升。
如表2所示,2010年至今,我国临床注册申报受理号数排名前列的产品主要有三种情形:一是普通固体制剂之间的互换,例如片剂改胶囊、胶囊改片剂;二是普通固体制剂改缓控释制剂,但如果该缓控释制剂后来原研进口上市了,对应改良药注册申报就要改成仿制药注册申报;三是注射剂的氯化钠换葡萄糖,不含葡萄糖或氯化钠的加葡萄糖或氯化钠。无论是哪种情形,在化学药注册法规改革后都很难开展临床优效研究。
2015年自查核查中,共有98个改良型新药公告撤回,其中98%的注册申请都是生产申报。撤回受理号数排名前三的托拉塞米分散片、阿托伐他汀钙分散片和硫普罗宁肠溶胶囊,自撤回后暂无重新申报生产的数据,亦再无临床试验登记记录。
这再一次从侧面反映了化学药品注册改革之前我国的改良型药品,在新法规颁布后项目申报上市的难度非常大。其中最主要的原因是改良型新药相关的注册指导文件迟迟未能下达。企业要做改良型新药,目前只能考虑中美“双报”路线,根据数据共享的原则,美国获批后将有望加快国内审评上市的进程。
中美“双报”捷径?
美国505(b)(2)立项需诸多考量
国内企业开始研究在美国申报505(b)(2)项目可行性的热潮,无疑是受到了绿叶利培酮缓释微球肌肉注射制剂(LY03004)美国成绩单的激励——绿叶在美完成自行研发的用于治疗精神分裂症的利培酮缓释微球肌肉注射制剂(LY03004)的172名美国患者的3项关键性药代动力学试验,并且得到FDA确认其中美国108名病人参与的关键性临床试验足以支持LY03004通过505(b)(2)的途径在美国提交NDA,不需要再进行任何临床试验等。
505(b)(2)新药申请(NDA)是FDA三大药物批准途径之一。鉴于505(b)(2)批准途径允许不提交活性成分的安全性和有效性信息,与FDA传统的新药开发审批路径505(b)(1)相比,505(b)(2)审批路径更便宜和更快,同时能创造具有巨大商业价值的新的差异化产品。
以NDA号数进行统计,2015年FDA批准了505(b)(2)的NDA共106个,2016年84个,2017年126个。硫酸钡、硼替佐米、硫酸麻黄碱、苯丙胺、卡巴他赛、拉米夫定联合富马酸替诺福韦是505(b)(2)这三年获批数较多的产品。
服药路径方面,口服药和注射剂获批最多。近三年批准了20个缓释剂型,其中16个是口服药,如表3所示,这16个口服药中大多都是麻醉管控药。因此,国内的生产厂家要想仿制美国505(b)(2)的口服缓控释剂,可选择的成分也不多。
获批505(b)(2)的注射剂对应的化学成分主要是抗微生物用药和抗肿瘤药,其中化学半合成紫杉烷类小分子化合物卡巴他赛是近三年505(b)(2)获批产品数最多的化学成分。卡巴他赛在我国暂无产品获批上市,但已有不少国产生产厂家申报注册。
国内生产厂家感兴趣的吸入剂,近三年只批了6个,化学成分分别是丙酸倍氯米松、丙酸氟替卡松、富马酸福莫特罗、甘草酯、丙酸氯替卡松+沙美特罗+琥珀酸舒马曲坦。
通过比较近三年FDA上市的505(b)(2)产品和国内申报的改良药产品,可发现中美两国企业对产品选择的差异。要想开展505(b)(2)的中美双报项目,就要求国内企业的立项部门必须了解目前美国国内已上市的化学成分,并且要从临床角度出发分析改良剂型的必要性。
小结<<<
国内企业想要开展改良药项目,在化学药相关指导法规尚未明确、临床试验不知道如何展开之际,选择中美“双报”有其价值:美国505(b)(2)项目能减少竞争,减少申报注册中所需的非临床研究如安全性和有效性试验,活性成分是以前获批的化学药成分(相对而言审批风险较低),整体开发成本低,时间快,而且还可以获得三、五或七年的市场独占性。
然而,美国505(b)(2)更多的要考虑临床必需性,国内企业以往的一些片剂与胶囊互改的项目并不适合,需要平衡两地市场情况与法规,才有望找到中美两地都适合上市的产品。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



