医械法规体系变革 企业如何顺势而为
发布时间:2018-09-29 15:14:38作者:蒋海洪 徐键来源:医药经济报
当前,以新版《医疗器械监督管理条例》(以下简称《条例》)为核心、以部门规章为主体、以规范性文件为补充,我国已经构建了覆盖医疗器械监管全过程的医疗器械法规体系。这场大规模的法规巨变和制度更新,带给医疗器械行业什么影响?相关企业应该何去何从?
[产业影响大数据]
政策法规正经历巨变
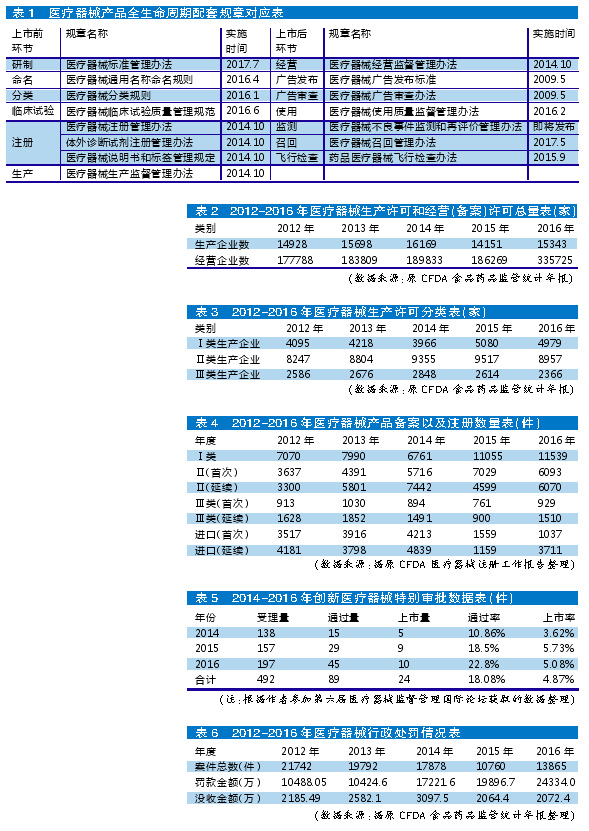
我国医疗器械法规体系构建始于2000年《条例》的实施,经过2014年、2017年的两次修订后,法规体系的框架已经基本确立。根据产品全生命周期管理的需要,管理部门对相关配套规章做了较大修改,基本上把原有医疗器械法规体系的内容回炉重造了一遍。同时,还发布了《创新医疗器械特别审批程序》《医疗器械优先审批程序》《医疗器械生产质量管理规范》《医疗器械经营质量管理规范》等多部规范性文件。
另外,为了推动这些管理规范的实施,国家药监局以各种通知、公告、通告等形式发布的规范性文件近百项。这些立法工作构建了行政法规、部门规章、规范性文件为主体框架的三级监管体系。可见,医疗器械政策法规正经历着一场巨变。
对产业规模的影响
医疗器械是一个严格监管的产业,对生产经营主体均有资质要求,法规修订会对产业规模产生明显影响,主要表现在获得资质的主体数量变化上。
2014年《条例》首次修订后,要求生产第二类、第三类医疗器械的企业应该取得《医疗器械生产许可证》,要求经营第二类医疗器械的企业应该取得经营备案凭证,经营第三类医疗器械的企业应该取得《医疗器械经营许可证》。
从表2可知,2012-2014年,由于法规没有大的修改,不管是医疗器械生产企业还是经营企业数量均呈缓慢增长趋势。2015年,因为新版医疗器械GMP和首版医疗器械GSP在该年的推行,医疗器械生产企业和经营企业数量均有所减少,一些不符合医疗器械GMP规范要求的生产企业以及不符合医疗器械GSP规范要求的经营企业被淘汰出局,表明新政对行业产生了立竿见影的影响。2016年,生产企业及经营企业总量均有所增加,说明熟悉新规则之后,更多的社会资源继续流入医疗器械这一朝阳产业。
从表3中可以更深入地了解新的政策法规实施对不同类别医疗器械生产企业的影响情况。2012-2015年,从事第一类、第二类医疗器械生产活动的企业均处于稳定增长状态。而对生产第三类医疗器械的厂家而言,2012-2014年这三年都有小幅增长,但在2015、2016年均有所减少。这与2015年3月国家开始要求第三类医疗器械生产企业全面执行医疗器械GMP规范有直接关系,生产质量体系不合规且整改不合格的企业直接遭到淘汰。
另外,我国从2015年9月开始实施《药品医疗器械飞行检查办法》。管理部门利用飞行检查手段,对医疗器械生产企业密集展开了不预先告知的行政检查。2016年,所有类别的生产企业数量均有所下降,这与当年严厉的飞行检查淘汰劣质企业不无关系。
对产品备案和注册的影响
医疗器械产品上市状况是行业发展的“晴雨表”,新实施的政策法规也直接影响着产品的备案和注册数量。如表4所示,2014年《条例》将第一类医疗器械产品注册管理调整为备案管理后,备案产品有了大幅上升,增长率达到63.5%。同时,第二类医疗器械的首次注册数,从2015年的7029件降低到2016年的6093件,降幅达到13.31%;进口医疗器械的首次注册数,从2015年的1559件降低到2016年的1037件,降幅达33.48%。两项数据的下降,表明2016年开展的医疗器械临床试验数据真实性核查行动对企业的首次注册申报产生了实质影响。另外,2015年开始实施的医疗器械注册收费制度也让企业对注册申请更为谨慎,影响了医疗器械生产企业的注册申请数量。在这些政策影响下,企业的备案与注册行为更加规范化,提升了产品备案与注册申报的质量。
值得注意的是,2016年体外诊断试剂异军突起,在注册产品中占比很大。从原CFDA公布的注册数据看,境内第三类医疗器械中,体外诊断试剂注册数量占全部注册数量的43%;进口医疗器械中,体外诊断试剂注册数量占全部注册数量的33%。这些都表明,在医疗器械行业版图中,体外诊断试剂所占的份额将越来越大。
我国于2014年3月开始实施《创新医疗器械特别审批程序》,允许符合条件的创新医疗器械进行特别审批。这一政策的出发点是缩短创新医疗器械的注册审评时间,以加快产品的上市步伐。但是,创新医疗器械产品属于高科技和学科交叉产品,风险性高,技术审评难度大,导致审评周期时间长,效率偏低。由于创新医疗器械的门槛要求高,再加上审评慢,致使该政策不能从根本上促进医疗器械行业的创新发展。
从表5可以看出,实施创新医疗器械特别审批程序后,创新医疗器械的通过量和上市量在三年里均稳步增长,但由于申报量越来越大,上市率稍有起伏。2015年,原CFDA批准注册脱细胞角膜基质等9个产品上市(其中有源医疗器械5项,体外诊断试剂3项,无源医疗器械1项)。2016年,批准注册三维心脏电生理标测系统等10个产品上市(其中有源医疗器械6项,无源医疗器械3项,体外诊断试剂1项)。2016年,不管是创新医疗器械的注册申请量,还是经过审评后的通过量以及最终获批的上市量,都有所上升,说明创新医疗器械特别审批这一新政继续推动着产业技术和产品的更新。
对产业发展环境的影响
经过大规模的政策法规变动之后,医疗器械产业发展环境也会发生很大变化,主要体现在制度环境变严和产业环境趋活两个方面。
一是经过政策法规的调整,医疗器械管理制度的“笼子”已经编织严密,从严监管成为产业管理主轴,制度环境变严了。2017年9月1日,《最高人民法院、最高人民检察院关于办理药品、医疗器械注册申请材料造假刑事案件适用法律若干问题的解释》开始正式实施。该项司法解释将药品和医疗器械临床试验数据作假纳入刑法处理,在刑罚层面进一步强化了行业的从严监管。除此之外,管理部门频繁的飞行检查、“双随机”检查、抽验检查以及临床数据真实性核查等行政检查活动,也使行业的制度环境变严了。
从表6可知,2012-2016年,行政处罚案件总数起伏不定。2015年查处的案件总数发生巨降,2016年有所回升。这表明《条例》修订后,由于不熟悉新的罚则,管理部门查处违法行为的行动力有所减弱,但后期增强了。从2013年起,罚款金额作为一个主要的处罚指标一直稳步上升,表明对医疗器械的监管力度和处罚力度仍在持续加强。由于法规加大了处罚力度,因企业生产经营方面的合规问题被罚高达近千万元的案例现在并不罕见。
二是系列关于鼓励行业创新发展的利好政策的出台,给行业带来新的发展机遇,产业发展环境趋向活跃。除了《创新医疗器械特别审批程序》这一政策将持续推动产业技术与产品创新之外,2017年1月开始实施的《医疗器械优先审批程序》,将加快那些治疗罕见病、恶性肿瘤有明显临床优势或列入国家科技重大专项、国家重点研发计划的器械上市步伐。
2017年5月,原CFDA连续发布了2017年第52、53、54、55号等4个关于鼓励药品医疗器械创新政策征求意见稿的公告,体现了药品医疗器械管理的改革趋势。2017年10月8日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,一些长期困扰医疗器械行业创新发展的瓶颈将会打破,对医疗器械产业的创新发展将产生深远而又重大的影响。
[给企业的建议]
医疗器械政策法规目前正处于变动期,并呈现出明显的严厉趋势。在日益趋严的产业环境中,政策法规的灵活性给行业带来了发展裨益。未来,企业应该既要下大力气做好质量合规,以满足严格的监管要求,又要善于利用政策红利,捕捉难得的发展机会。
把握政策法规发展方向
中办国办发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》反映了产业管理的最新发展动向,企业应该从中准确把握政策法规发展趋势,及早布局筹划新的发展规划。尤其是关于医疗器械注册审评的改革动向,企业应该保持密切关注。
做好上市前质量合规
在从严监管的行业环境下,企业必须扎实履行好法规规定的法律义务,尤其是要做好医疗器械产品上市前的质量合规管理。企业应该在研发、检验、临床试验、注册以及生产等上市前环节里,不折不扣履行法律法规规定的义务,确保质量管理体系有效运行。
2017年新修订的《条例》已经将医疗器械临床试验机构的资质认定改为备案管理,这已经在立法上先于药品确定了临床试验机构的备案管理制度。未来将有更多符合条件的机构能够提供专业的临床试验服务,这对于医疗器械的质量合规大有裨益。
履行上市后主体责任
未来,基于产品全生命周期管理的需要,管理的重心将继续从产品上市前审批向上市后监测转移,从而要求企业在产业发展全程承担一以贯之的法律义务。医疗器械生产企业及使用单位应按照上市后产品的不良事件监测、再评价以及召回的相关规定,积极申报不良事件和召回缺陷产品。企业应加强自律,严格把关产品质量,防止不良事件的发生对产业造成打击。医疗机构应对在用医疗器械做好集中管理,使其把有限的人力、财力、精力都集中到医疗技术上,提升内涵、持续创新、提高诊疗水平和质量,使医疗技术更富含金量。
实施差异化发展策略
当前,医疗模式正在从过去的“诊断-治疗”模式向“预防-诊断-治疗-康复-保健”模式转变。在此背景下,医疗需求将呈现新的趋势,家用医疗仪器、家用辅助类机器人设备、社区康复用医疗设备、面向电子健康档案的技术与产品将成为新的热点产品领域。在新的法规和政策环境中,3D打印医疗器械、移动医疗设备、基因测序、家用医疗器械等细分行业应抓住机遇,以差异化发展策略取得竞争优势。
(全文详见《医疗卫生装备》2018年第1期)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



