抗肿瘤新药的全球新、中国风
发布时间:2018-09-20 20:54:23作者:吴健(科睿唯安)来源:医药经济报
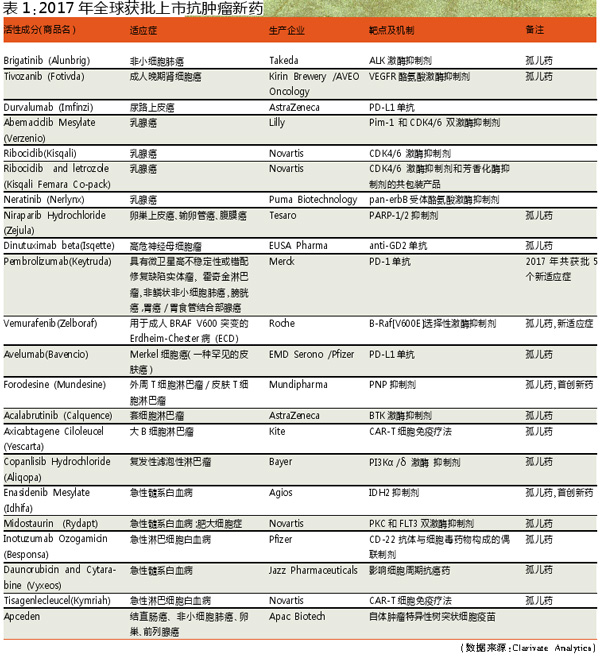
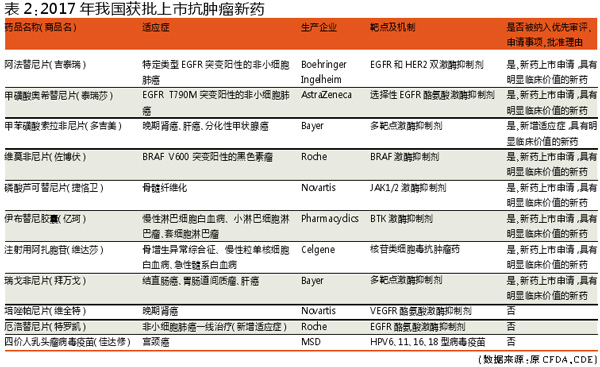
2017国内外获批上市抗肿瘤新药对比
抗肿瘤新药的全球新、中国风
科睿唯安最新发布的新药报告The year’s new drugs & biologics 2017显示,2017年全球首次批准了113个新化学药和生物药。其中,有52个新药在2017年已经上市销售,包含7个首创新药(first-in-class);36个为扩展品种(新适应症、新复方组合、原有产品的新配方);还有25个品种已批准但未能在2017年12月31日之前上市销售。
抗肿瘤药物仍然是全球药物研发和上市最热门和最活跃领域,而这一趋势在2017年我国批准上市的新药中同样得到体现。
在全球52个已上市销售的新药中,抗肿瘤药物以17个占据首位,占比约为33%,远超过第二位的中枢神经系统药物(6个,12%)。在全部113个新药当中,抗肿瘤药物有22个,占比接近20%。
我国CDE《2017年度药品审评报告》显示,2017年CDE接受国产1类创新药注册申请和进口药新药注册申请的适应症集中在抗肿瘤等领域。2017年我国共有11个抗肿瘤新药获批上市,其中8个属于“具有明显临床价值的新药”通过优先审评程序得以加快批准上市。
对比2017年全球和我国获批上市的抗肿瘤新药,可以发现国内外在该领域的诸多不同点和相同点,从中也可以透析我国抗肿瘤药物的发展趋势。
创新靶点PK
中外差距仍大,但中国研发在快跑
2017年全球获批的22个抗肿瘤新药中,共有10个不同类别的激酶抑制剂(包括1个共包装产品)、5个单抗(包括1个抗体偶联制剂)、2个全新靶点的first-in-class类首创新药、2个CAR-T细胞免疫疗法药物、1个PARP-1/2抑制剂、1个影响细胞周期抗肿瘤药和1个抗肿瘤疫苗产品。
2017年我国获批的11个抗癌药新药中,包括9个不同类别的激酶抑制剂、1个核苷类细胞毒抗肿瘤药和1个抗肿瘤疫苗产品,其中激酶抑制剂类抗肿瘤药超过八成。获批的11个药物均为国外已上市的进口抗肿瘤药物。
随着对肿瘤相关基础科学以及抗肿瘤药物研究的不断深入,临床对肿瘤的治疗手段已从最原始的手术和放射治疗,逐步扩展到小分子化疗药物、靶向药物、免疫疗法、基因治疗等创新而多样化的治疗方式。在一段时间内,小分子蛋白酶抑制剂依然是全球抗肿瘤药物的主体。但是,随着对肿瘤生物标志物、基因表型、细分靶点和信号通路等因素的深入研究,这些因素对药物研发起到更确切的指导作用,对实际疗效也将起到愈加重要的影响。在此基础上,更加个性化、明显改善患者生存期和生活质量的靶向和免疫疗法,将成为未来全球及我国抗肿瘤药物的发展方向。
2017年获批的抗肿瘤新药Keytruda(新增适应症)以及两种CAR-T疗法药物尤其体现了这一趋势。默沙东的Keytruda针对MSI-H和dMMR两种肿瘤标志物而非肿瘤来源进行治疗,被誉为“首个广谱抗肿瘤药”具有里程碑意义。全球上市的首个和第二个CAR-T疗法——Novartis的Kymriah和Kite的Yescarta,可使经基因改造的免疫细胞特异性识别肿瘤细胞表面的抗原,进而攻击肿瘤细胞并将其杀死,标志着对肿瘤的治疗真正进入了变革性疗法时代。
我国抗肿瘤新药的研发与国际先进水平尚存在一定差距,但相当多的国内企业目前已着眼于CAR-T、PD-1/L1等靶点以及新型抗肿瘤药物的研发,并同步进行国内外多中心临床试验,紧随全球靶向及免疫抗肿瘤药物的发展趋势,相信未来将逐步缩小与国际先进水平的差距。
适应症PK
疾病谱不同,中国上市产品符合中国需求
2017年全球获批上市抗肿瘤新药的适应症主要集中在白血病/淋巴瘤(9个)、乳腺癌(4个)及其他罕见病。
同期我国获批上市的抗肿瘤新药主要集中在肺癌(3个)、白血病/淋巴瘤/骨髓纤维化(3个)、肾癌(2个)和肝癌(2个)。
WHO最新报告World Cancer Report 2014显示,2012年全球恶性肿瘤新增病例约为1400万例,死亡病例约为820万例,预计到2035年全球恶性肿瘤新增病例将达到2400万例。全球范围内恶性肿瘤发病率、死亡率、疾病负担和用药需求的快速增加,使得抗肿瘤药物在全球药物市场中占据了主体地位。2017年全球畅销药物TOP15中,有6个属于抗肿瘤药物。
目前我国恶性肿瘤的防控形势也十分严峻,最新数据显示,2014年全国新发恶性肿瘤病例约380.4万例,死亡病例229.6万例;全球约有21.8%的新发恶性肿瘤病例和26.9%的恶性肿瘤死亡病例发生在我国。
但值得注意的是,我国恶性肿瘤疾病谱与发达国家存在不同。
★我国主要新发恶性肿瘤:肺癌(20.6%)、胃癌(10.8%)、结直肠癌(9.75)、肝癌(9.6%)、女性乳腺癌(7.3%)、食管癌(6.8%)、甲状腺癌(4.5%)、子宫颈癌(2.7%)、脑癌(2.7%)和胰腺癌(2.4%)。肺癌(20.6%)、胃癌(10.8%)、结直肠癌(9.75)、肝癌(9.6%) 合计占我国全部恶性肿瘤新发病例的50%以上。
★北美主要新发恶性肿瘤:前列腺癌(14.6%)、乳腺癌(14.3%)、肺癌(13.4%)、结直肠癌(8.9%)、膀胱癌(4.3%)、黑色素瘤(4.2%)、非霍奇金淋巴瘤(3.9%)、肾癌(3.6%)、甲状腺癌(3.2%)。
★欧洲主要新发恶性肿瘤:乳腺癌(13.5%)、结直肠癌(13.0%)、前列腺癌(12.1%)、肺癌(11.9%)、膀胱癌(4.4%)、胃癌(4.1%)、肾癌(3.3%)、胰腺癌(3.0%)、黑色素瘤(2.9%)。
不同的恶性肿瘤疾病谱,显示我国临床抗肿瘤用药需求和其他国家存在一定差异,进而在一定程度上影响国内外具体上市药物的种类和市场规模。
不过,在2017年我国获批上市的抗肿瘤药物中,也有数个用于罕见肿瘤的重点药物。预计未来制药企业将不局限于常见的肿瘤类型,而是从我国肿瘤患者的实际需求和市场定位出发,推出更多罕见肿瘤用药,最大程度地满足我国肿瘤患者的治疗需求。
药审重心PK
全球七成新药是孤儿药,中国重视临床价值
2017年全球获批上市的22个抗肿瘤新药中,有15个获得FDA授予的孤儿药认定资格,其他药物也获得了各国不同程度的加速审批政策的支持。
我国同期获批上市的11个抗肿瘤药物中,则有8个属于“具有明显临床价值的新药”继而通过优先审评程序得以加快批准上市。
为提高患者用药可及性,鼓励企业加速开发新型药物,在药品审评审批方面给予研发企业不同的支持政策和措施是世界各国通行的做法。FDA有快速通道认定、突破疗法认定、加速批准和优先审评四种加快新药研发的特殊审评政策,对孤儿药更是有较长的市场独占期、减税及研发补助等激励政策。
从2005年开始,我国相继推出特别审批、重大专项、特殊审批和优先审评审批等促进药品加快审评政策;2017年我国加入ICH,成为其全球第八个监管机构成员,标志着我国药品的监管审批与国际标准接轨。特别是2017年发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《关于鼓励药品创新实行优先审评审批的意见》,以及2018年4月国务院常务会议对包括进口抗癌药在内的创新药的支持政策,在审评流程、机制、临床试验、知识产权等方面,都极大地利好具有明显临床价值、患者急需的创新药在我国的研发和上市。
进口抗肿瘤药不断受益于我国药品审评审批制度的深入改革:2017年原CFDA批准进口抗癌药品临床试验的平均时间114天,比2014年的243天缩短了129天;批准进口抗癌药品上市的时间平均为111天,比2014年的420天缩短了309天;2017年3月批准上市的晚期肝癌新药瑞戈非尼片进口批准上市时间比全球首个上市国家美国仅晚7个月。这些数字预示着未来将有更多进口抗肿瘤药实现国内外同步上市。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



