CAR-T也遇商业化魔障,怎么破?
发布时间:2018-09-20 15:27:53作者:廖联明来源:医药经济报
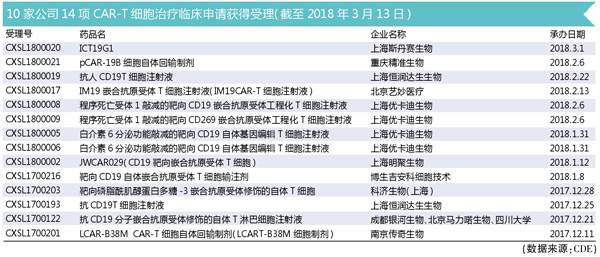
备受瞩目的CAR-T已然开始了其璀璨明珠之旅。2017年8月31日第一个CAR-T疗法(kymriah,诺华)上市,同年10月19日第二款CAR-T疗法Yescarta获批。其中,吉利德公司是通过收购凯特制药获得Yescarta,从而占领了市场先机。2017年12月8日,南京传奇率先在中国申报了CAR-T细胞治疗临床试验申请,并在2018年3月12日获得CFDA批准。截至2018年3月13日,CFDA受理了14个CAR-T细胞治疗临床申请。
CAR-T,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞免疫疗法。由于在急性白血病和非霍奇金淋巴瘤的治疗上有显著疗效,CAR-T被认为是最有前景的肿瘤治疗方式之一。
嵌合抗原受体(CAR)是CAR-T的核心部件,赋予T细胞以HLA非依赖的方式识别肿瘤抗原的能力,这使得经过CAR改造的T细胞相较于天然T细胞能够识别更广泛的目标。CAR的基础设计中包括一个肿瘤相关抗原(tumor-associated antigen,TAA)结合区(通常来源于单克隆抗体抗原结合区域的scFV段)、一个胞外铰链区、一个跨膜区和一个胞内信号区。
目标抗原的选择对于CAR-T的特异性、有效性以及安全性都是关键的决定因素。理想的目标抗原是仅在肿瘤细胞表面表达的肿瘤特异性抗原,不幸的是肿瘤表达的大多数抗原不具备肿瘤特异,因此导致“脱靶”效应和不良反应。目前已上市的Kymriah和Yescarta的靶点是CD19。
而即便是光芒四射的CAR-T,也如所有的技术一样需要经历一个漫长的演化、成熟过程。
商业化魔障
CAR-T疗法得到不断完善并进入市场,但其商业化之路要取得成功,仍面临着许多难题,比如:如何建立新型的医院与生产企业之间的合作模式,以简化供应链?如何进一步研发出有效的手段来预防和处理严重的毒副作用?如何使得保险机构或国家医保系统介入,以提供可持续发展模式?
对于先进机制产品的商业化,有个经典的失败案例——曾经风光无限的Dendreon公司治疗前列腺癌的免疫细胞产品Provenge。
1992年,Dendreon公司成立。2010年4月29日,美国FDA批准Provenge用来治疗无症状或具有轻微症状的转移性去势抵抗性前列腺癌,成为全球首个上市的自体免疫细胞疗法。
然而2010年后,Dendreon公司营业状况却每况愈下,原因归结于保险公司没有将Provenge加到理赔药品清单上。该产品的价格接近10万美元,而其治疗的中位生存期仅提高约4.1个月。大多数病人在知道这个疗效数据后不愿购买Provenge,直接导致销量低迷。
2015年2月23日,加拿大Valeant公司以4亿多美元的价格将Provenge买断,Dendreon公司宣告破产。今年1月10日,中国民营企业三胞集团与Valeant公司达成股权收购协议,收购Dendreon公司100%股权,从而成为全球首个前列腺癌细胞免疫疗法Provenge的拥有者。
而对于CAR-T疗法的商业化难题,笔者总结为以下几个方面:
难题1
生产、供应链复杂,成本高
CAR-T细胞的生产是一项艰巨的任务。最初,CAR-T细胞是利用学术机构以及设备遵循现行GMP生产的。学术机构生产经验丰富、技术成熟,但规模小。先在当地医院采集病人的外周血细胞,再将其送到生产机构,经基因工程改造、扩增后,再将细胞送回医院,注入患者体内。
目前大部分研究都是使用自体T细胞生产CAR-T。T细胞亚群的分选、载体的制备、T细胞的激活、扩增用的生物反应器、细胞培养时间、冷冻保存方法、细胞的终浓度和放行检查等都十分复杂。因此,要使CAR细胞的生产在根据质量源于设计(quality-by-design)的原则下放大,使工业化生产不但方法稳定而且有理想的成本效益比是很困难的。由此,应该选择适合细胞疗法的独特的商业模式。
此外,大多数临床研究都是先从自体血液中分离出原料,然后再生产CAR-T细胞。自体CAR-T细胞的生产,始于PBMC的收集。但即使对生产程序的参数做了精确调整,产品的有效率仍相对较低,有时含有的CD3+T细胞浓度达不到要求。这归因于患者疾病严重程度不同,先前接受了不同的治疗。医院的血液分离设备在CAR-T细胞收集的方法和程序上一直都有异质性。
分离程序上的差异可能对CAR-T细胞的生产效率产生重大影响。若生产失败了,就要仔细分析生产过程中每一环节造成的误差。因此有必要通过建立专门的细胞收集设施,采用统一的步骤收集细胞。虽然这解决了细胞生产流程上的问题,但患者可能需要亲自前往其他城市或国家接受治疗,从而增加经济负担。
供应链方面,大多数CAR-T细胞的生产商计划将基因治疗药物作为冷冻保存品进行销售。相比常温运输人细胞悬浮液,以冷冻保存的方式运输对细胞的生物学性能影响较小,但该法装运成本高。此外,冷冻保存产品到达目的地时应如何处理?例如:临时存储设备的条件是什么?如何解冻?如何注射解冻品?医院药房和细胞处理部门的责任各是什么?这些问题都有待解决。
抗CD19 CAR-T细胞疗法的临床试验表明,一个集中生产机构可为四个州的25个医院提供服务,周转时间为2~3周。
难题2
毒性控制尚在研究中
接受CAR-T细胞疗法的大多数患者都出现了不同程度的细胞因子介导的毒性,症状表现为发烧到呼吸窘迫综合征或严重的神经毒性等危及生命的不良反应,因此需要超适应症使用抗IL6-R托珠单抗等药物辅助抢救。目前正在研究神经系统综合征的因果机制,发现很多观察性和经验性方法都可用于这些不良反应的预防。
在朱诺公司的一个名为Rocket的试验中,与CAR-T疗法有关的死亡率高达13%,其中有5名患者因出现脑水肿而死亡,2017年3月FDA叫停这项试验。有研究认为,可采取以下几个方法来降低毒性:通过整合的自杀基因选择性消耗CAR-T细胞,通过集成的ON-Switch赋予双重输入调节,或者使CAR-T细胞在低氧环境也能产生反应等。
但在法国生物技术公司Cellectis开发的CAR-T疗法UCART123的一项临床试验中,由于出现了一例因严重神经毒性而死亡的患者,FDA在2017年9月下令停止这项临床研究(禁令在2017年11月被解除)。这个事故对“自杀基因有助于提高CAR-T疗法的安全性”和细胞治疗开发者承诺的“CAR-T疗法试验是安全的”提出了质疑。
相关动物模型研究认为,安全、按需给予患者活性药物,是提高细胞疗法安全性的两个重要条件。
难题3
法规生产要求不利商业化
虽然各国对CAR-T疗法的法规原则是相似的,但也有不同的地方。根据欧盟国家第EC2007/1394条法规,CAR-T细胞疗法被归为基因治疗药物产品、先进治疗药物(advanced therapy medicinal product,ATMP)的范畴。该归类的目的是促进这类新型医疗产品的开发,确保其功效和安全性,并促进它们的临床应用。与细胞移植物不同,ATMP属于医药产品,目标是商业化。
按照EC2007/1394条法规,CAR-T疗法的生产管理和供应模式应该按照传统药物或生物制剂的集中生产模式。
但早期的经验表明,按照传统药物生产模式,即集中生产模式对ATMP进行生产,效率非常低,不利于商业化,因为集中生产模型会使个性化体细胞药品或基因疗法药品的成本高到不可思议的程度。加上这些ATMP本就存在市场规模小、产品运输不方便、临床疗效优势小等不足,因此大多数ATMP的商业化都失败了。
此外,大多数成员国的医疗保健机构还没有为这类产品建立可持续的报销模式。因此,如果CAR-T细胞疗法能够采用当地生产模式(point-of-care),可降低上市批准、生产和销售的费用。
为了协调各国之间的不同监管制度,欧盟在2009年成立了自愿协调程序(Voluntary Harmonization Procedure,欧盟第536/2014条法规),并于2014年通过修订。
CAR-T攻略
不过,CAR-T细胞疗法的开发环境和背景与第一批已上市的ATMP有很大不同。因为如今无论是中小企业,还是大型制药公司都在积极寻找合作伙伴,并投入大量资金开发CAR-T细胞疗法。此外,CAR-T细胞工程的设计和开发工具一直在改进,供应链和物流也更加成熟。
“当地生产”取代
“集中生产”
已有公司将半自动化技术引入了CAR-T细胞的生产过程。CliniMACSProdigy(Miltenyi Biotech)等实验室设备可以支持全自动、封闭的临床级细胞生产(每次一个患者)。将来,CAR-T细胞生产过程的每个步骤也可以使用不同的设备,这些设备组成一条生产线,与其他行业的生产流程类似。生产过程的操作干预或过程检测可被降到最少,使生产效率提高,降低生产成本。
此外,完全一体化的生产设备有助于摆脱集中生产模式,可以在离医院尽可能近的地方生产基因治疗药物产品,采集自病人的细胞和加工后的细胞的运输更加简单,成本也可大大降低,制备周期也可缩短。Ziopharm和朱诺治疗公司正在开发当地生产平台。
开发通用型CAR-T
相对生产患者特异性CAR-T细胞,开发通用型细胞产品(off-the-shelf product)具有潜在优势。可由捐赠者提供细胞,然后根据病人的大致需求通过基因工程对CAR-T细胞进行改造。这可实现CAR-T细胞的批量生产,而且不同生产批次间的差异程度要小于个体化的CAR-T细胞疗法。但需要对批次生产的产品的安全性和有效性进行监控,包括确定患者的最大耐受剂量,并在给药前对此批产品的免疫原性和抗宿主反应性进行充分验证。
若可利用多能干细胞或T细胞前体细胞生产同种异体CAR-T细胞,将有利于降低集中生产模式的成本。这个想法也许还需要很久才能变为现实。
不过,这种同种异基因产物会提高移植物抗宿主病(GvHD)和移植物排斥的风险,因此需要采用一些措施避免这些风险,如对病人和通用型产品之间进行HLA配型,选择配型吻合的产品。
Cellectis公司是第一家向FDA递交通用型CAR-T临床研究的公司,其研发的CAR-T细胞(代号UCART123)用于治疗急性骨髓性白血病(AML)和胚胎性浆细胞样树突状细胞肿瘤(BPDCN)。但一名输注了UCART123的患者的死亡,引发了人们对这些细胞成品安全性的担忧。
拓展适应症
CD19靶点的血液恶性肿瘤的发生率毕竟不高,CAR-T细胞疗法的商业化要取得成功必须依赖于拓展新的适应症,尤其是实体瘤。
目前,CAR-T细胞疗法治疗实体瘤的主要瓶颈包括:寻找靶细胞表面特异性抗原;CAR-T细胞如何归巢到肿瘤部位并克服免疫抑制性肿瘤微环境。
结语
对人体细胞和组织疗法的发展感兴趣的企业都非常关注CAR-T细胞疗法的发展前景。CAR-T细胞是将具有商业可行性的细胞疗法推向市场的第一个代表产品,这是一个长久以来备受期待的成就。
但是,如果没有可持续的商业模式出现,医药企业就会减少对CAR-T疗法的投资,从而导致开发创新性细胞疗法的学术研究面临资金挑战。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



