哪些证据和过程适用于医保补偿
发布时间:2018-08-23 20:42:54作者:胡善联来源:医药经济报
哪些证据和过程适用于医保补偿
亚太地区专家说法
从全球的发展情况来看,澳大利亚、加拿大和欧洲部分国家,如英国是较早采用卫生技术评估、成本效果分析和药物经济学研究的国家。从上世纪90年代起,这些国家便对创新药物开展评价和定价研究,但总的说来研究得还不够深入。有观点认为,药物经济学的应用放缓了各国医疗费用支出的增长速度;但也有观点认为,卫生费用的增长并没有获得根本的改变。同样,在药物治疗对健康的收益和健康的损失方面,亦研究得不够。
在第20届欧洲药物经济学与结果研究大会亚洲ISPOR专场,来自中国、韩国、日本的专家,围绕“亚太地区的药物创新和市场准入——什么样的证据和过程适用于医疗保险补偿”这一主题,介绍了其所在地的情况。
中国大陆
药价和医保可承受性决定新药能否入市
笔者在报告中介绍了近年来中国药品市场准入政策的变化。
2017年2月发布的新版国家基本医疗保险药品目录中,新增了15%的品种,共计2535种基本医疗保险报销药品;继而人力资源与社会保障部对36个创新和专利药物的价格谈判成功,预示着药物经济学评价和预算影响分析已经在药品价格谈判中得到了应用。
四种医疗高值耗材,包括冠状动脉支架系统、人工髋关节、植入式心脏除颤器系列和心脏再同步治疗系列的价格,也在同年开始谈判。2017年10月后,两个重要的影响药品市场准入的政策先后出台,包括国务院办公厅发布的《关于进一步改革完善药品生产流通使用政策的若干意见》和中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》。
报告对基本医疗报销药品和谈判药品的特征、遴选条件和价格谈判过程、降价的比例、药品分类以及取得的效果进行了介绍。引入药物经济学评价,对提高新药的可及性和促进中国医药工业发展的作用是十分明显的。鉴于中国各省经济发展的不平衡,谈判药物价格的补偿比例在各地也不尽相同。药品价格和医疗保险基金的可承受性仍然是今后新药能否进入中国市场的一个重要因素,动态目录的调整和高价药的谈判将在今后工作中形成常态化。
韩国
卫生技术评估由多部门合作进行
韩国国立健康和临床研究协调中心(NHCR)和国家循证保健合作机构(NECA) 的Sukyeong Kim专家在报告中介绍了韩国的药品市场准入情况。
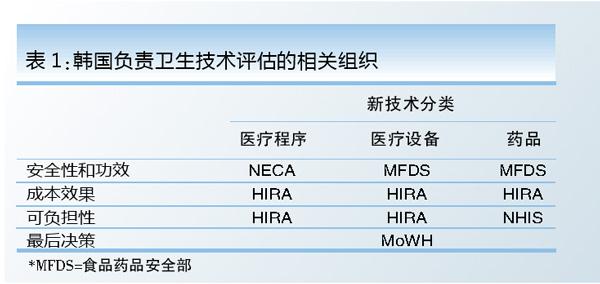
韩国从1977年开始启动医疗保险计划,到1989年已实现全民覆盖。其中,大约还有3%的人群受到医疗救助计划的资助,全国已成立了统一的、单一支付的医疗保险制度。韩国健康保险的管理机构由四个部门组成(见表1):卫生福利部(MoHW)负责计划和决策,国家健康保险部(NHIS)负责参保、财务和支付,健康保险回顾和评价服务机构(HIRA)负责参保人员的报销、服务包设计和服务质量,国家循证卫生保健合作机构(NECA)则负责卫生技术评估和健康干预。医保的支付方式基本上仍然是按项目付费。
药企向健康保险回顾和评价服务机构(HIRA)提交的新药申请报告,一份是临床疗效报告,包括治疗效果、药品替代能力、治疗的必要性;另一份是成本效果经济学报告,包括成本水平、增量成本效果比值(ICER)、资料的质量。前份报告由肿瘤审议委员会审议,后份报告由经济评价分会审议。然后根据医疗保险基金费用,由国家健康保险部(NHIS)进行药价谈判,最后由卫生福利部(MoHW)做出决策。
2006年韩国引入药品报销目录后,卫生费用呈快速增长的趋势。2014年起引入风险分摊机制,主要是针对药品目录中一些仍在使用的没有成本效果的药物或循证证据不够充分的药物,如罕见病药物、低收益利润的药物、价格谈判没有成功的药物等。药品进入医保目录的推荐率为69.2%,其中抗肿瘤药物入选率较低,在51.6%左右。
韩国正在推进效益增强计划,包含四种情况:进口药品、孤儿药、抗肿瘤药物、建立CED组织采用资金返回和支付封顶等方法。目前韩国有11种药品采用风险分担的定价方法,包括氯法拉滨(clofarabi)、艾库组单抗(eculizumab)、西妥昔单抗(cetuximab)、利那度安(linalidomide)、恩扎鲁胺(enzalutamide)、克唑替尼(crizotinib)和凡德他尼(Vandetanib)等。从2007年起韩国开始采用新的技术评估方法,对一些新的医疗程序不管带有或不带有医疗设备均需要对其安全性和有效性进行系统回顾。包括对已有的技术(16.6%)、新的卫生技术(37.8%)、早期的医疗技术和尚处于研究阶段的技术(34.5%),均要评估。目前采用的多部门同时评审的一站式服务系统,将评估时间缩短了半年。
日本
价格评价新体系将引入成本效果分析
2012年5月日本厚生省成立了成本效果分析(CEA)委员会,Inventiv Health 副总裁Bruce Crawford在会上介绍,该委员会在2014-2015年内部会议中对成本效果评价分析方法进行了讨论,由药企提供成本效果评价结果。2016年起,日本开始实施对药物进行成本效果分析的要求,并提出了纳入和排除标准。2017年3月,要求药物和器械公司提供成本效果分析资料;同年10月后开始讨论如何将成本效果分析结果用于新药定价系统中,建立成本效果评价的相关组织,并鼓励第三方对药物的成本效果进行再评价。预计在2018年4月后,成本效果分析的结果将被系统地应用到新的价格评价体系中去。但是,不同的利益集团对以成本效果分析为基础的卫生技术评估的作用的认识存在分歧:医保方面认为,成本效果分析只能用于药品的降价或保持价格,不能用于提高价格;药企的观点是,成本效果分析既能用于降价,也能用于提高价格,降价会阻碍药品创新,市场价格不能真正反映出药品的价值。
日本成本效果分析委员会提出一些创新思路,例如,如何调节QALY的阈度。以前曾提出6个伦理和社会标准:(1) 从公共卫生角度来体现效用,如防控传染病;(2)在公共卫生领域,除了成本效果分析外还有附加成本;(3)治疗严重疾病,尽管不一定能明显提高生活质量但可以延长生存时间;(4)无改良的治疗方法;(5)创新治疗方法;(6)儿科治疗。最近建议放弃第5条和第6条。日本CEA委员会认为,单纯用ICER值来评价有一定局限性,从公共卫生角度考虑,以后还应该考虑伦理和社会因素。当用ICER值来评价时不能是固定的值,原则上ICER值是与意愿支付的程度有关(willingness-to-pay),不能简单地认为成本效果是好还是不好,应对ICER值进行分层,如果1个QALY定为500万日元时,应该属于1-2 级(segment),如果1个QALY为1000万日元,应该属于2-3级(segment)。按5%贴现率计算。
也可用日本真实世界研究的结果与国外HTA的结果进行比较,以支持卫生技术评估的决策。50%的日本人的支付意愿为4850万日元;英国NICE的终末期治疗的阈度定为5万英镑,相当于7270万日元。
第三种情况是英国NICE认为可接受的水平应在2万~3万英镑之间,相当于4360万日元。所以日本将小于500万日元的阈度作为第1级,其药价不需要调整。500万~1000万之间的阈度作为第2级,药价需要根据ICER值调整。如果QALY值大于1000万日元的话,属于第3级,这些药物的价格就需要下降到一定的程度。
中国台湾地区
药品市场准入分为两个阶段
CC.Chang教授在报告中介绍了台湾地区采用两阶段药品市场准入过程。药品企业要求将一个新药列名的话,需要提交评价新药的建议,向台湾“健保局”申请,证明新药的价值(value of pharmaceutical product, 简称VOPP), 需要经过卫生技术评估(见表2)。第一阶段提交材料到药物效益委员会,由专家评审,召集会议并提出HTA报告;第二阶段由药品效益和补偿委员会(PBRS)来审批。公布会议纪要,如果取得共识,会提出支付条件或签订价格数量协议,并将结果提交“卫生署”年度公布结果。如果没有取得共识,也可将结果提交“卫生署”。一种可能性是发回“健保局”重新修改,另一种可能性就是新药被否定,则申报过程到此结束。
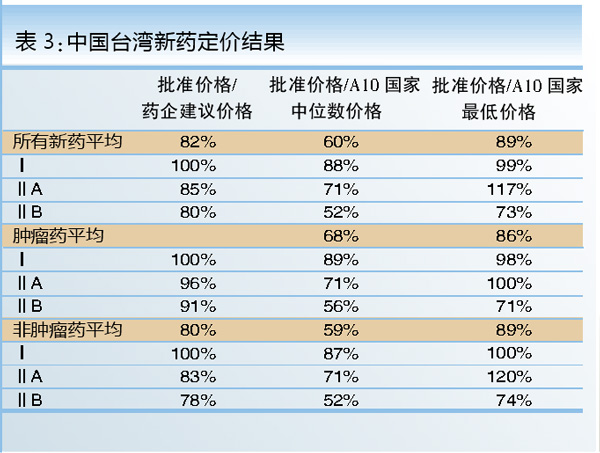
台湾地区的新药定价也很有特色。首先,台湾地区的药品定价是参考10个国家(A10),包括美国、加拿大、日本、澳大利亚、英国、法国、德国、瑞典、瑞士、比利时。台湾地区将申请的新药分成三类:Ⅰ类为创新药物,ⅡA类药物具有中度效果的改善,ⅡB类药物与现有市场上已有的药物具有相同的临床效果。一般来讲,一个新药大约平均需要3.9个月通过专家会议评估后即可获得补偿。
台湾地区的新药参考定价按类别分成肿瘤药和非肿瘤药。一般来讲,创新药物可以有高定价,ⅡA和ⅡB类药物则呈梯度下降。在参考定价时可以取A10国家的最低价或中位价,药企也可提出建议的价格,但最后由“健保局”提出批准的价格。总的趋势是,批准价格相当于A10国家中位数价格的60%或最低价格的90%(见表3)。
台湾地区对药品的评估一般要经过四个步骤:首先是通过文献检索和收集评价标准,目的是了解新药的结构;第二步是通过10个专家的访谈,包括决策者、临床专家、患者组织,了解新药的合理性和治疗指标;第三部分是网站连线调查研究;最后通过10个专家焦点组访谈取得共识。
新药评价的结构包括四个部分:(1)总临床效益,包含临床效能、安全性、效果比较、临床疾病负担、临床未满足的需要和治疗的创新性;(2)从患者角度考虑可及性、可负担性、选择性和生活质量;(3)经济价值,包括疾病成本、增量成本效果比值(ICER)、预算影响评价;(4)对卫生系统的可行性,包括组织的可行性和卫生系统的价值。

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



