在研580种药物 哪些领域受追捧
发布时间:2020-05-19 14:55:39作者:刘小东来源:医药经济报
研究和开发适合儿童和婴儿的创新药是美国生物制药公司的重要优先事项。研究人员正在研究开发满足婴儿、儿童和青少年独特需求的药物,这些开发中的药物带来了希望,意味着过去几十年来在儿童健康方面的显著改善将继续下去,甚至还会加速。
由于新的治疗技术和手段取得的进展,2008-2014年间被诊断出癌症的儿童中有83%生存期为5年或更长时间,而1970年中期这一比例仅为58%。
【在研】
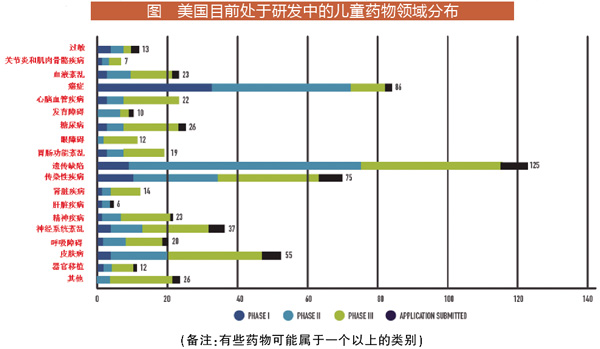
在研580种药物治疗领域分布
除了开发专门针对儿童的新药之外,生物制药公司还在测试目前获准用于成人的许多现有药物,以确定儿童安全有效的剂量水平和给药途径。目前在美国有580种用于婴幼儿、儿童和青少年的药物正在开发中,这些药物处在临床试验或等待美国FDA审查阶段。包括:
NO.1治疗囊性纤维化在内的125种遗传疾病的药物。在美国,囊性纤维化影响着3万多名儿童和成年人。
NO.286个癌症治疗药物。癌症仍然是美国1~19.7岁儿童疾病死亡的主要原因。
NO.375个用于治疗艾滋病、耳部感染、肺炎和肝炎等传染病的药物。
NO.455种皮肤疾病药物,包括特应性皮炎,这是一种影响美国约20%儿童的慢性疾病。
NO.537种用于神经系统疾病的药物,包括可能用于癫痫的新疗法。美国约有47万儿童患有癫痫。
NO.626种糖尿病药物。糖尿病在美国20岁以下人群中发病率呈上升趋势,2002-2012年,1型糖尿病发病率每年增长1.4%,2型糖尿病发病率每年增长7.1%。
NO.723项精神疾病药物和疗法,包括严重的精神疾病,目前影响大约22.2%的美国青少年(13~18岁)。
NO.723项血液疾病药物和疗法,包括镰状细胞病和缺铁性贫血。
NO.922项心血管疾病药物,包括高血压、高胆固醇和先天性心脏病。
NO.1020项用于治疗呼吸系统疾病的药物,包括治疗哮喘的药物。哮喘是美国儿童最常见的慢性疾病,受影响的儿童超过600万。
NO.1119个胃肠道疾病药物,包括炎症性肠病、克罗恩病和溃疡性结肠炎等。这些疾病影响着美国14万名年龄在18岁以下的未成年人。
NO.1214个肾脏疾病药物,如肾小球硬化(肾脏血管硬化)和慢性肾脏疾病等。
NO.1313个抗过敏药物,包括花生过敏等。
NO.1412个用于与移植有关的疾病的药物,如移植物抗宿主病(供体细胞攻击并损害移植受者的健康细胞)等。
其他研究领域包括发育障碍、眼疾和肝病等。
儿科临床试验中的药物
目前在研药物治疗领域包括传染病、神经疾病、遗传疾病和几种癌症,包括:
1.一种单克隆抗体被批准用于治疗成人和12岁及以上儿童哮喘
目前该药正在对6~11岁儿童进行测试。哮喘是15岁以下儿童住院的第三大原因。在嗜酸粒细胞性哮喘中,嗜酸粒细胞在肺组织中积累,并对通道内壁造成损害。
2.已获批用于成人2型糖尿病的美国首个DDP-4抑制剂
目前正在10~17岁儿童中进行测试。这种药物增强了肠促胰岛素系统,该系统通过影响胰腺中的β细胞和α细胞来帮助调节葡萄糖。
3.以基因编辑技术为主的细胞疗法
该疗法通过锌指核酸酶(ZFNs)用于镰状细胞病的一次性治疗,它由一种含有DNA剪切酶的蛋白质组成,利用胎儿血红蛋白修改患者自身的造血干细胞,使其产生正常形状的红细胞。
4.已获批用于预防成人偏头痛的一种单克隆抗体
目前正在开展6~17岁儿童偏头痛的临床试验。该抗体结合并抑制降钙素(CGRP)基因相关肽的活性。CGRP在神经系统中表达,在控制血管扩张和神经性疼痛信号的传递中起重要作用。研究表明,CGRP依赖的细胞信号通路可能参与了偏头痛的发展途径。因此,抗CGRP的抗体被认为有助于抑制与偏头痛相关的细胞信号传导过程。
5.一种用于17岁以下患者白血病和淋巴瘤的CAR-T疗法
CAR-T疗法利用患者自身的T细胞来识别并杀死癌变肿瘤细胞。为了进行这种治疗,患者的血液被过滤去除T细胞,然后在实验室里植入另外一种基因,针对癌细胞特有蛋白质的受体进行编码,从而改变T细胞。然后将T细胞回输到病人体内,与癌细胞结合并杀死癌细胞。
6.多巴胺/去甲肾上腺素再摄取抑制剂治疗注意缺陷/多动障碍(多动症)
在临床试验中,这种潜在的治疗方法在注意力不集中和多动症症状方面都有显著改善,临床试验的对象包括6~12岁的儿童。
【已批准】
最近批准的儿科药物标签
1.最近,首个针对囊性纤维化患者的三联疗法获得批准。该疗法至少有一个最常见的基因突变副本,适用于12岁以上的患者。囊性纤维化跨膜传导调节基因(CFTR)的F508del突变存在于约80%的囊性纤维化患者中。三联疗法旨在增加细胞表面缺陷CFTR蛋白的数量和功能。
2.一种被批准用于治疗成人复杂腹腔内感染(cIAI)和复杂尿路感染(cUTI)的药物,在完成了三次儿科临床试验后,获得了FDA的批准,将标签扩大到包括3个月及以上的儿童和婴儿患者。这是十多年来FDA首次批准的儿童cUTI和cIAI适应症,并解决了严重的健康风险的感染,特别是对脆弱和敏感的儿童患者,几乎没有治疗选择。
3.首个自体抗-CD19CAR-T细胞免疫治疗被批准用于25岁以下的儿童和青年患者的B细胞游离急性淋巴细胞白血病(ALL)。在CAR-T免疫疗法中,患者自身的T细胞经过基因改造,重新注入血液,在血液中,这些细胞可以与目标癌细胞结合并摧毁它们,同时最大限度地减少对其他非癌细胞的影响。
4.最近批准一种1994年首次获批的抗凝剂用于治疗一个月及以上患儿的静脉血栓栓塞症(VTE)。这种疾病会阻碍肺循环。静脉血栓栓塞症在儿童中常见,这是第一种被批准用于治疗有生命危险血块的抗凝血剂。
5.所有6种丙型肝炎病毒(HCV)的首次治疗被批准用于12~17岁儿童。该药物2017年首次被批准用于成人,是直接作用抗病毒药物的一部分,可通过防止病毒繁殖,将体内的丙肝病毒数量降低到不可检测的水平。美国大约有23,000到46,000名儿童感染丙肝病毒。
6.脊髓性肌萎缩症(SMA)的第一个也是唯一一个基因疗法被批准用于治疗小于两岁的儿童患者。SMA是一种罕见的遗传性疾病,它会导致进行性肌肉无力、瘫痪,如果不及时治疗,还会成为婴儿死亡的主要原因。这种治疗方法通过用潜在的单次输注替换导致该疾病的缺陷或缺失的基因,从而解决了SMA的根本原因。
【挑战】
儿科研究复杂性增加50%以上
在儿科药物开发不断取得进展的同时,生物制药公司在儿科药物研究方面仍然面临挑战。
根据塔夫茨大学药物开发研究中心2016年的一项调查显示,接受调查的大多数生物制药公司都表示,自2008年以来儿科研究的复杂性增加了50%以上。复杂性增加的原因包括缺乏与年龄相适应的参与者、缺乏临床试验的有效终点、缺乏足够的安全信息开始研究,以及在儿童和成人人群中疾病表现的差异。
四大挑战
数据显示,儿科药物研究的挑战主要包括:
挑战1:完成一项儿科药物开发计划可能需要15年,而获得成人批准的儿科标签只需9年;
挑战2:每年每个试验点只有不到两名儿科患者参与试验,30%的试验点从未登记过一名患者;
挑战3:2008-2016年,大多数公司的儿科药物开发成本至少增加了25%,近一半的公司报告说增加了50%以上;
挑战4:FDA的一份报告显示,42%的儿科试验未能证明建立新的或扩大的儿科标签所必需的安全性和有效性。
儿科药物研发需要所有利益相关者(包括患者、研究人员和监管决策者)之间加强沟通和协作。科学和技术的进步,包括确定个别患者对特定治疗反应的新颖而强大的工具、新颖的临床试验设计、先进的统计方法,以及对现实世界证据的使用,为推进儿科研究和药物开发带来了希望。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用,包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






