赛默/百诚入局,齐鲁、万融健诚等特应性皮炎大品种首仿之争,谁会是赢家?
发布时间:2024-04-02 21:30:29作者:郑淼来源:医药经济报
聚焦儿童特应性皮炎领域的潜力大品种,一场围绕原研药企的抢仿战役已经拉开序幕。
近日,浙江赛默制药以仿制4类提交的克立硼罗软膏上市申请获得CDE承办受理。目前,国内市场只有原研药企辉瑞的克立硼罗软膏获准上市销售,还未有其他制药企业获批生产该产品的仿制药。
这次以仿制4类提交的克立硼罗软膏上市申请的浙江赛默制药,是A股上市药企、仿制药CXO龙头百诚医药的全资子公司,是一家定位于“原料+制剂”的全面服务、创新药与仿制药的定制化服务以及商业化生产的CMO/CDMO企业。截至2023年6月30日,浙江赛默制药累计已完成项目落地验证270多个品种,申报注册133个品种。对于这次辉瑞的克立硼罗软膏,浙江赛默制药似乎也是志在必得。

据悉,克立硼罗软膏是一种新型的小分子、非激素、非甾体类抗炎的磷酸二酯酶4(PDE-4)抑制剂,用于缓解皮肤炎症,有效改善特应性皮炎的皮损、瘙痒等症状。长期研究证实,克立硼罗软膏间歇性使用的安全性和耐受性良好。此外,克立硼罗软膏还于2019年被纳入《第二批临床急需境外新药》名单。
当下,已有多家制药企业入围克立硼罗软膏仿制药“决赛圈”,随着浙江赛默制药入局,首仿之战将愈演愈烈。与此同时,一批制药企业正在加大力度布局研发克立硼罗软膏的同靶点药物。可以预见的是,这一细分领域的市场竞争将更加白热化。
市场高速增长
专利悬崖如何求变?
特应性皮炎(AD)是一种慢性、复发性、炎症性皮肤病,通常初发于婴儿期,可延续至儿童期、青少年甚至成年。该病呈慢性经过,临床表现多种多样,最基本的特征是皮肤干燥、慢性湿疹样皮损和明显瘙痒,部分患者可同时伴有其他过敏性疾病,如过敏性哮喘、过敏性鼻结膜炎等。
近年来,随着生活方式和生活环境的改变,全球范围内AD患病率逐渐增加。数据显示,全球高达10%的成人和20%的儿童患有AD。在我国,AD患病率近10余年来增长迅速,呈现出年龄越小发病率越高的特点。其中,1-7岁年龄段儿童AD患病率为12.9%,1岁以下婴幼儿AD患病率高达30.48%。按照病情严重程度,AD可分为轻度、中度和重度三级,而在我国儿童AD患者病情严重度大多为轻中度。
目前,国内儿童AD一线治疗推荐外用糖皮质激素(TCS),但长期大面积使用可能导致皮肤和系统性不良反应,外用TCI不良反应主要包括局部烧灼和刺激感。儿童AD患者(特别是2岁以下儿童)治疗药物及手段尚不能完全满足医疗需求,克立硼罗软膏的出现,让这一情况有所缓解。
克立硼罗软膏由AnacorPharmaceuticalsInc.研发,2016年5月,辉瑞斥资52亿美元收购该公司并获得此药物;同年12月,克立硼罗获得美国FDA批准上市,商品名为Eucrisa,成为彼时10年来首个获批上市的AD处方药,也是首个抑制皮肤PDE-4的非甾体外用药物。
2020年2月,辉瑞在中国提交克立硼罗软膏上市申请,同年7月获批上市,用于治疗2岁及以上轻至中度AD患者的外用药物,这也是中国首个获批的非激素性PDE-4抑制剂。2023年8月,克立硼罗软膏在国内获批新适应症,将适用年龄范围从2岁以上拓展至3个月以上。
事实上,AD最早在婴儿出生后两周就会发生,出生2个月以后发病者居多。随着新适应证获批,克立硼罗软膏的适用年龄低至3月龄,预期能够为儿童AD患者(特别是2岁以下儿童)提供更多的治疗选择。
从销售数据来看,辉瑞克立硼罗软膏近年来的市场表现同样不俗。基于良好安全性,克立硼罗软膏已经是全球第二大治疗特应性皮炎的化学药物,年销售额约3亿美元。在中国,2021年,克立硼罗软膏通过国家谈判被纳入国家医保乙类目录。进入医保后,克立硼罗软膏在国内市场处于高速增长阶段。据米内网数据显示,在2023年上半年中国公立医疗机构终端化药软膏剂产品销售额TOP20中克立硼罗软膏位列第18名,从增速来看,克立硼罗软膏增速最快,达116.05%。
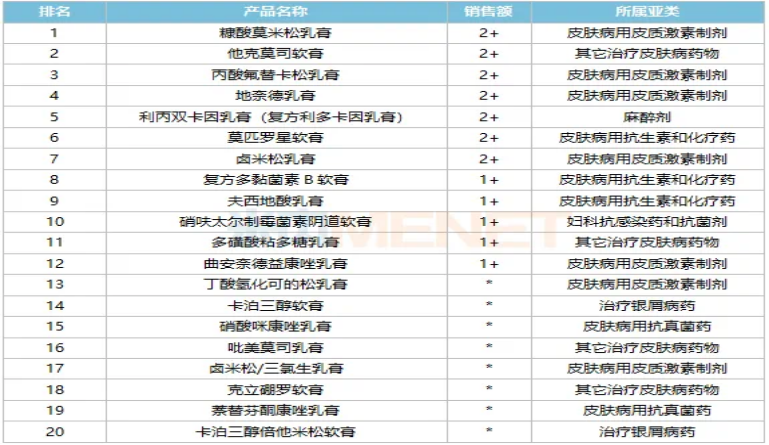
2023年上半年中国公立医疗机构终端化药软膏剂产品TOP20(单位:亿元)
来源:米内网中国公立医疗机构药品终端竞争格局
注:销售额低于1亿元以*表示
在业内看来,克立硼罗软膏的上市打破了国内十余年来在外用非激素抗炎领域无新产品的现状,同时填补了我国儿童AD被满足的治疗需求。在去年新适应症拓展至3个月以上的轻度至中度AD患者后,克立硼罗在儿童群体的应用范围无疑将进一步得到扩大,有助于市场规模的新一轮增长。
除AD外,辉瑞的克立硼罗软膏还在白癜风、系统性硬化症等适应症方面应用发展,进一步拓宽护城河,但也同样无法推迟“专利悬崖”的到来。根据CDE药品专利信息登记平台,克立硼罗的核心化合物专利将于2026年到期,这也是国内仿制药企加快仿制步伐的重要原因。
七家药企争夺首仿
PDE-4抑制剂成研发热点
事实上,围绕辉瑞克立硼罗软膏的首仿之争已经打响,赢家或许将在不久后决出。
除了最新报产的浙江赛默制药外,还有多家企业提交了克立硼罗软膏仿制药上市申请,包括南京万融健诚医药、齐鲁制药、杭州领业医药、浙江高跖医药、江西科睿药业、江苏万高药业等。其中,南京万融健诚早在2023年3月就进行了克立硼罗软膏仿制药的上市申报;2个月后,齐鲁制药的上市申请也获得受理。
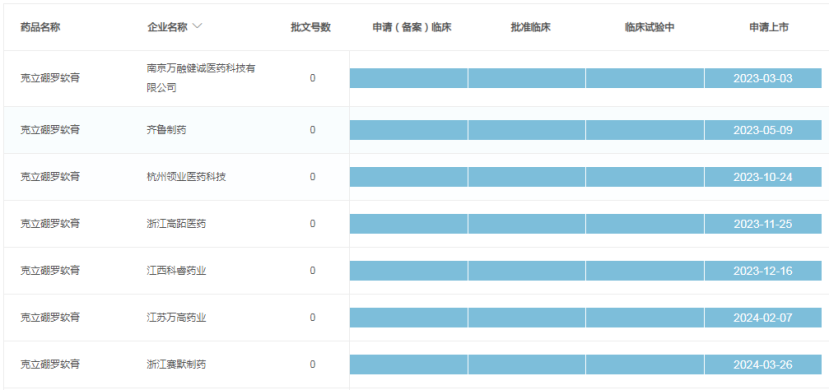
谁将斩获首仿,率先进入市场,还需要时间揭晓答案。除了已经进入审评审批序列的7家药企外,还有近30家的仿制药企业登记了克立硼罗软膏的BE实验,入局竞争是迟早的事情。未来,克立硼罗软膏或将形成数十家仿制药企业参与竞争的局面,这也说明行业一致认可相关疾病的潜力市场,但谁能脱颖而出称雄市场尚不可知。
而各大药企纷纷涌入克立硼罗软膏的热情也绝非没有依据。作为自免领域的核心赛道,AD由于患者多、市场空间大,目前仍存在巨大未满足的临床需求。作为新一代治疗炎症性疾病的明星药物,PDE-4抑制剂在国际和国内市场上均取得了亮眼的成绩。
目前,国内上市的PDE-4抑制剂除了辉瑞的克立硼罗外,还有安进的阿普米司特。早在2020年,阿普米司特全球销售额就超过20亿美元。截至2023年底,在研进入临床的PDE-4抑制剂约有十余种,其中包括恒瑞医药的HRS-9821和正大天晴的TQC-3721等。

PDE-4抑制剂的治疗潜力也得到了行业的青睐。近年来,已有多家制药企业就PDE-4抑制剂达成收购或合作。2023年8月,华东医药全资子公司中美华东与ArcutisBiotherapeutics宣布签署许可协议,获得了后者PDE-4抑制剂罗氟司特外用制剂在大中华区及东南亚的独家许可。而在此之前,安进、辉瑞、阿斯利康、信达生物、济川药业、丽珠医药等公司也通过合作或收购开发PDE-4抑制剂。
2023年10月,丽珠医药全资子公司丽珠集团丽珠制药厂,与苏州兰晟医药有限公司就兰晟医药开发的LS21031签署了一项在大中华区的专利及技术转让协议;
2022年11月,济川药业宣布与恒翼生物签署合作协议,就后者口服PDE-4抑制剂等两款创新药在中国大陆地区达成商业化战略合作,涉及总金额约为4亿元;
2021年9月,信达生物与UNIONtherapeutics宣布就后者用于治疗炎症性皮肤病的PDE-4抑制剂orismilast达成在中国的独家授权协议。为此,UNION公司将收到2000万美元的首付款,并有权获得累计不超过2.47亿美元的里程碑付款等;
2021年6月,优锐医药通过一项2.19亿美元的战略合作,获得了在大中华区开发和商业化VeronaPharma在研的一款吸入式PDE-3/4双抑制剂新药ensifentrine(RPL554)的独家权利;
2019年8月,安进宣布以134亿美元的价格收购口服小分子PDE-4抑制剂阿普米司特(Otezla);
2016年5月,阿斯利康宣布已完成对武田呼吸系统核心业务的收购,以扩大包括口服PDE-4抑制剂roflumilast在内的权利。
可以看到,PDE-4抑制剂已成为各大药企争相追逐的热门领域。跟随辉瑞、阿斯利康、安进等制药巨头的脚步,恒瑞医药、正大天晴、信达生物等国内制药头部玩家也纷纷开始积极布局后续管线。不难想见,这条赛道上未来还会有更多玩家接踵而至。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用,包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886765;yyjjb@21cn.com。






