赛诺菲Dupixent冲击“超级重磅”!AZ、GSK之后,一波三折的COPD生物药曙光乍现?
发布时间:2023-03-28 11:43:54作者:甄言来源:医药经济报
在上周赛诺菲核心产品Dupixent(dupilumab,度普利尤单抗)刚刚获得欧盟批准用于治疗6个月至5岁儿童的严重特应性皮炎之后,一则热点消息引发行业关注。
赛诺菲日前官方宣布,Dupixent在一项针对慢性阻塞性肺病(COPD)的后期试验中取得了成功,这一结果有望让该药成为第一种获准治疗COPD的生物药抗体治疗。
COPD作为一种异质性很强的疾病,新药临床开发难度存在极大挑战。在此之前,无论是阿斯利康的Fasenra(benralizumab)还是葛兰素史克的Nucala(mepolizumab),作为抗体疗法均在COPD的临床研究中折戟沉沙。
市场观点认为,COPD在全球影响接近4亿人口,是全球第三大死亡原因,这意味着巨大临床需求和市场空间,如果Dupixent能够最终在这一适应症获得成功,跨过“两百亿美元”超级重磅门槛也绝非遥不可及!
COPD能否突破?
“超级重磅”或将诞生
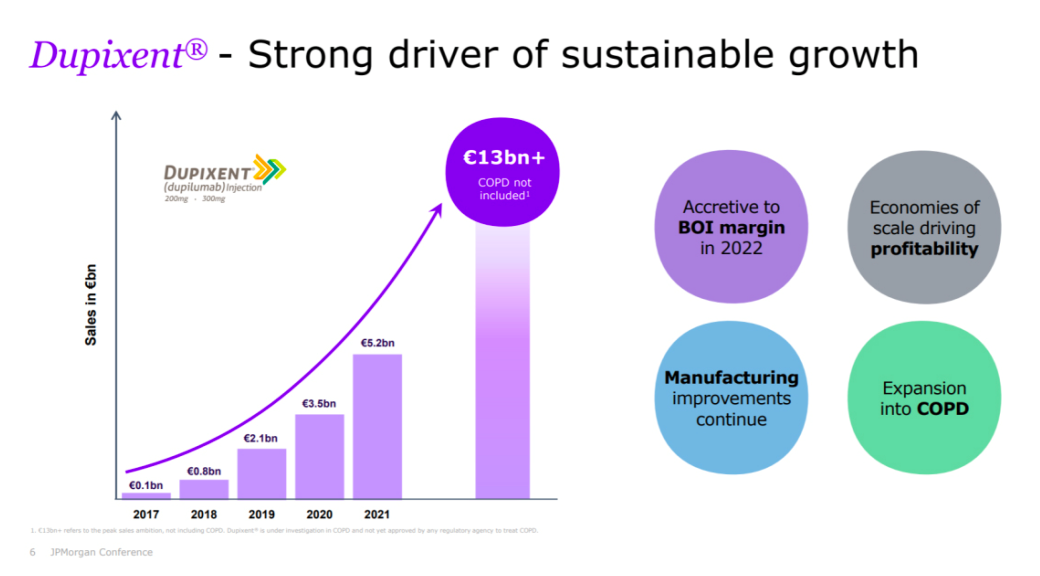
今年2月份,赛诺菲和再生元相继公布了2022年财报。Dupixent过去一年的销售收入超过82亿欧元,同比增长超过43%,成为驱动企业全年收入增长的核心动力。按照企业的预期,2023年Dupixent销售额将突破百亿欧元。
能否达成这一目标,关键的决定性因素就是COPD适应症的成败。
COPD是一种进行性疾病,可引起肺部气流阻塞,导致呼吸困难。截至目前,改善肺功能,减少急性加重(exacerbation)和控制日常症状,依然是临床治疗的主要选择,临床存在巨大的未被满足的临床需求。
本次公开的信息主要关于BOREAS研究,是一项随机、双盲、安慰剂对照的III期临床项目,旨在评估Dupixent在伴发气道疾病2型炎症的中重度慢阻肺患者中的疗效、安全性和耐受性。
BOREAS研究共有939位年龄介于40-80岁,抽烟或曾有抽烟历史,并带有2型炎症(血中嗜酸性粒细胞数≥300细胞/µL)的患者入组。在52周治疗期间,患者在吸入型糖皮质激素(ICS)、长效β受体激动剂和长效毒蕈碱拮抗剂的三联治疗中,额外每两周接受一次度普利尤单抗或安慰剂治疗。
初步的分析数据显示,试验达主要终点,与安慰剂组相较,在52周内度普利尤单抗可统计上显著并具临床意义地减少患者COPD症状恶化达30%。第12周时,度普利尤单抗组患者的肺功能较基线改善160mL,而此数值于安慰剂组为77mL(p<0.0001),与安慰剂相比的获益持续至第52周(p=0.0003),两者均为关键次要终点。

不过,有专家观点表示,Dupixent的临床试验设计进行了针对性优化,比如在入组标准中明确限制了基线嗜酸性粒细胞>300cell/µL,以应对此前临床中出现过的2型炎症较低的患者响应率偏低的问题;此外,有部分入排标准也受到过一定的质疑,比如未能明确要求嗜酸性粒细胞数量持续保持较高水平、将哮喘患者排除在外等。
资本市场显然更为乐观。根据Precedenceresearch报告显示,2021年全球哮喘和COPD市场规模约353亿美元,2022-2030年的复合年增长率为5.4%,而目前COPD常规药物依然以小分子化学药为主,主要头部企业包括阿斯利康、勃林格殷格翰、GSK、诺华等。
行业分析指出,赛诺菲去年年底已经将Dupixent的销售额预测值提升至130亿欧元,随着适应症的扩展,Dupixent已经开始成为修美乐和Keytruda之后,下一个药王的有力争夺者;此外,130亿预期其实还没有包括COPD适应症,一旦这个大适应症得到突破,200亿“超级重磅”目标也指日可待。
投资者预期乐观
能否成就Best-in-class?
作为赛诺菲和再生元联合开发的核心产品,Dupixent已被美国FDA批准治疗包括特应性皮炎、哮喘、慢性鼻窦炎伴鼻息肉病(CRSwNP)、结节性痒疹和嗜酸性食管炎(EoE)等疾病,这些疾病的关键驱动因子皆为IL-4和IL-13。
众所周知,针对2型炎症疾病治疗药物,除了Dupixent能够抑制IL-4和IL-13这两条上游通路激活,还有很多其他机制的免疫调节剂,如靶向IgE、IL-5、嗜酸性粒细胞相关因子等。
以哮喘适应症为例,Dupixent和目前已获批的IL-5疗法,如阿斯利康的Fasenra和葛兰素史克的Nucala相似,均被批准用于嗜酸性粒细胞增多的哮喘患者。
然而,COPD和哮喘客观而言是两种有区别的疾病,以至于众多不同机制的生物药产品在此前的临床中遭遇挫折。
2018年,阿斯利康相继宣布GALATHEA和TERRANOVA两项III期试验失败,将哮喘药物Fasenra适应症拓展至COPD的希望遭遇到空前的打击。
同样的遭遇也发生在葛兰素史克IL-5抑制剂Nucala身上。2017年11月,GSK向FDA递交了Nucala作为吸入性皮质类固醇维持方案的附加疗法治疗嗜酸性粒细胞性COPD的新适应症申请,其sBLA的数据依据是两项临床III期研究:MEA117106和MEA117113,其主要终点均为52周中重度COPD恶化的发生率。2018年,美国FDA对Nucala在COPD使用证的疗效提出了质疑,2018年9月,FDA拒绝了Nucala作为COPD的附加治疗。
如果说,阿斯利康和葛兰素史克的产品仅仅是在COPD适应症拓展过程中栽了跟头,那么礼来靶向IL-13(R)的Lebrikizumab和阿斯利康的Tralokinumab不仅COPD没能闯关成功,哮喘适应症也遭遇了坎坷。
从最新的临床进展来看,Dupixent站在COPD这个广阔市场的大门口,一只脚已经迈了进去,无论是作为细分领域的先行者,亦或如部分投资者预期的很可能存在Best-in-class潜力,Dupixent掀起的COPD市场竞争战火,已经越燃越旺。
投资者对此给予了积极的预期,就在官方宣布临床研究进展之后,赛诺菲和再生元股价暴涨。

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用,包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886765;yyjjb@21cn.com。






